Медицина/7. Клиническая
медицина
Ігошина
А.В., Статінова О.А., Ніколенко О.Ю., Безсмертна О.В., Ладарія О.Г.,
Ніколенко В.Ю.
Донецький
національний медичний університет ім.М.Горького, м. Донецьк, Україна
Особливості імунних та
аутоімунних порушень при гострих гіпоксичних енцефалопатіях у гірників
вугільних шахт
В останні роки відмічається збільшення числа гірників із
гострими ураженнями нервової системи внаслідок впливу різних небезпечних
факторів виробничого середовища вугільних шахт у вигляді отруєнь метаном,
монооксидом вуглецю, гострих перегрівів [3, 4, 10, 12]. За даними Всесвітньої Федерації Токсикологічних
Центрів, у світі відбувається формування токсичної ситуації, яка пов'язана з
ростом числа отруєнь, зареєстрованих у всіх країнах світу [15]. Близько 5% від
числа всіх звернень по невідкладну медичну допомогу у дорослих пов'язані з
гострими отруєннями і 2-5% о – з отруєннями у дітей [10]. Такі ураження
супроводжуються розвитком органічної неврологічної симптоматики, яка часто дає
залишкові симптоми та приводить до інвалідності [5, 11, 12]. Причина стійкого зберігання
порушень, що розвиваються після ураження нервової системи, можуть полягати у
розвитку порушень імунітету, який щільно пов’язаний з нервовою системою і завжди
бере участь у репаративних і захисних процесах в організмі [1, 12]. Тому головною метою роботи
було вивчення основних показників імунітету у гірників з гострою гіпоксичною
енцефалопатією внаслідок отруєння метаном.
Матеріал і методи. Обстежено імунологічними
методами 35 гірників вугільних шахт із гострою гіпоксичною енцефалопатією
внаслідок отруєння метаном. Контролем були показники імунітету 32 здорових гірників.
Середній вік хворих із отруєнням метаном становив (39,8±0,8) років, а у контролі
– (38,9±1,4) років. Середній підземний стаж роботи у шахті становив (10,4±1,1) років, в контролі – (11,2±1,5) років. Серед
постраждалих гірників 27 хворих мали легке отруєння метаном, 7 – помірне, 1 –
тяжке. Імунологічне обстеження включало вивчення фагоцитарної активності
нейтрофілів за результатом тесту з нітросинім тетразолієм (НСТ-тесту),
визначенням експресії поверхневих маркерів Т- і В-клітинних субпопуляцій
лімфоцитів СД3+, СД4+, СД8+, СД16+, СД22+ за допомогою стандартного набору
моноклональних антитіл. Проводили визначення концентрації імуноглобулинів
класів А, М, G, середньомолекулярних циркулюючих імунних комплексів (ЦІК), вивчали титри
аутоантитіл до антигену головного мозку в реакції пасивної гемаглютинації
(РПГА), гіперчутливості уповільненого типу (ГУТ) до цього ж антигену в реакції
гальмування міграції лейкоцитів (РГМЛ) [2, 6, 7, 8, 14]. Статистична обробка отриманих результатів
проводилась на персональному комп’ютері за допомогою пакету
ліцензійної програми “Microsoft Excel”. Проводили оцінку середніх значень ![]() , їх похибки - S
, їх похибки - S![]() , обчислювали коефіцієнт
кореляції (r), критерії Стьюдента
(kS), Фішера (kF), Крускала-Уоліса (kKW) і достовірність статистичних показників (р) [9].
, обчислювали коефіцієнт
кореляції (r), критерії Стьюдента
(kS), Фішера (kF), Крускала-Уоліса (kKW) і достовірність статистичних показників (р) [9].
Результати досліджень. Результати дослідження фагоцитарної функції нейтрофілів за допомогою
НСТ-тесту наведено в табл.1.
Таблиця 1
Фагоцитарна функція
нейтрофілів крові за НСТ-тестом у гірників, що перенесли отруєння метаном, і в
контролі (![]() ±S
±S![]() )
)
|
Показники |
Групи |
Статистичні відмінності |
||||
|
|
хворі n=35 |
контроль n=32 |
kS |
Sp |
kF |
Fp |
|
НСТ-тест, % |
15,71±0,72 |
20,93±0,63 |
-3,61 |
p<0,001 |
2,03 |
0,048 |
|
Спонтанний ІАН |
0,261±0,005 |
0,323±0,012 |
-3,43 |
0,0010 |
2,90 |
0,0029 |
|
Стимульований НСТ-тест, % |
21,80±0,64 |
26,74±1,16 |
-2,69 |
0,0088 |
2,14 |
0,032 |
|
Стимульований ІАН |
0,42±0,02 |
0,59±0,02 |
-3,67 |
p<0,001 |
2,10 |
0,040 |
Як видно з таблиці, у хворих після гострого отруєння метаном
відмічається зменшення кількості нейтрофілів, які виявляють фагоцитарну
активність до (15,71±0,72)% в спонтанному НСТ-тесті і до (21,80±0,64)% у стимульованому
пірогеналом у порівнянні з контролем (20,93±0,63)% і (26,74±2,1)% (kS=3,61, p<0,001;
kF=2,03, p=0,048 та kS=2,69, p=0,0088; kF=2,14, p=0,032 відповідно). Індекс
активації нейтрофілів (ІАН) без стимуляції, а також при додаванні пірогеналу
становив (0,261±0,005) і (0,42±0,02) та вірогідно відрізнявся від контролю –
(0,323±0,012) і (0,59±0,02) відповідно (kS=3,43, p<0,001; kF=2,90, p=0,0029
та kS=2,67, p<0,001; kF=2,10, p=0,040 відповідно). Таким чином, зменшення
ІАН у хворих при спонтанному та стимульованому фагоцитозі свідчить, що фагоцити
мають низьку резервну активність внутрішньоклітинних ферментів і під час
активації це може приводити до значної загибелі нейтрофілів і недостатності
фагоцитарної ланки імунітету.
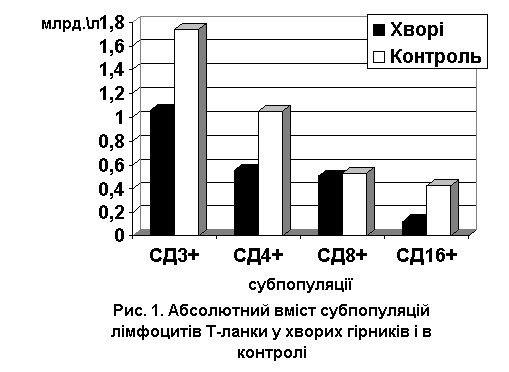
Деякі показники Т-клітинного імунітету наведені на рис.1.
У хворих визначено зменшення відносного і абсолютного вмісту Т-лімфоцитів за
результатами визначення поверхневих рецепторів СД3+
абсолютний і відносний вміст яких становив у групі хворих (58,2±1,4)% і
(1,06±0,03)х109/л у порівнянні з контролем (74,7±0,8)% і
(1,74±0,08)х109/л відповідно (kS=9,25, p<0,001; kF=2,03, p=0,048
та kS=6,29, p<0,001; kF=2,55, p=0,0088 відповідно). Дослідження розподілу
субпопуляцій Т-лімфоцитів показало, що у хворих має місце зниження як
відносної, так і абсолютної кількості клітин хелперної ланки СД4+ до (30,3±0,6)% і (0,554±0,020)х109/л у порівнянні з контролем (45,5±0,8) % і
(1,049±0,049)х109/л відповідно (kS=10,13,
p<0,001; kF=1,37, p=0,366 та kS=7,48, p<0,001; kF=3,13, p=0,0014
відповідно). Одночасно встановлена вірогідна різниця в бік збільшення у хворих
тільки по відносній кількості Т-супресорних клітин із СД8+-рецепторами
(27,8±0,8)% і (0,505±0,021)х109/л
між хворими та контрольною групою (22,3±0,6)% і (0,529±0,030)х109/л (kS=3,55,
p<0,001; kF=3,19, p=0,0015 та kS=0,47, p=0,637; kF=1,21, p=0,578
відповідно). Унаслідок значного зменшення кількості
лімфоцитів хелперної ланки співвідношення CD4/CD8 вірогідно було меншим у групі
постраждалих гірників, становлячи (1,19±0,05), у порівнянні з контрольним показником
(2,06±0,05) (kS=8,38, p<0,001;
kF=1,55, p=0,218 (p<0,001). Експресія на природних кілерах СД16+-рецепторів була значно зменшена і становила (6,9±0,3)% і (0,124±0,007)х109/л у
порівнянні з контролем (18,4±0,6)% і (0,421±0,017)х109/л
(kS=12,26, p<0,001; kF=2,07, p=0,040 та kS=9,70, p<0,001; kF=6,31, p<0,001
відповідно). Таким чином, за результатами дослідження Т-ланки імунітету
встановлено, що у хворих із гострою гіпоксичною енцефалопатією при отруєнні метаном
розвивається Т-клітинний імунодефіцит, переважно за рахунок зменшення вмісту
Т-хелперів та збільшення відносної кількості Т-супресорів. Таке розбалансування
імунної системи може бути початком регенераторних процесів, але в подальшому це
може призвести до розвитку аутоімунного процесу [1].
За результатами порівняння показників В-ланки
імунної системи у хворих із гострою гіпоксичною енцефалопатією внаслідок
отруєння метаном видно, що у них має місце вірогідне зменшення кількості
В-лімфоцитів при аналізі експресії СД22+-рецепторів, як відносної їх кількості
до (15,8±0,4)%, так і абсолютної до (0,287±0,011)х109/л у порівнянні з
контролем (17,7±0,5)% та (0,417±0,021)х109/л відповідно (kS=2,07, p=0,041; kF=1,08, p=0,821 та kS=3,86, p=0,00026; kF=2,34,
p=0,016 відповідно).
У хворих із гострою гіпоксичною енцефалопатією при
отруєнні метаном вміст імуноглобулінів у сироватці крові класу G становив
(9,67±0,23) г/л і був вірогідно нижчим у порівнянні з контролем – (11,83±0,19)
г/л (kS=4,66, p<0,001; kF=2,12, p=0,036 відповідно), що може свідчити про
значне пригнічення В-ланки імунітету. Також відмічено вірогідне зменшення
вмісту Ig А до (1,41±0,04) г/л у порівнянні з контролем (1,91±0,07) г/л (kS=4,18,
p<0,001; kF=2,24, p=0,023 відповідно), що може свідчити про підвищення напруження
місцевої імунної відповіді і може призвести до виникнення гострих або
загострення хронічних інфекційних захворювань (рис.2).
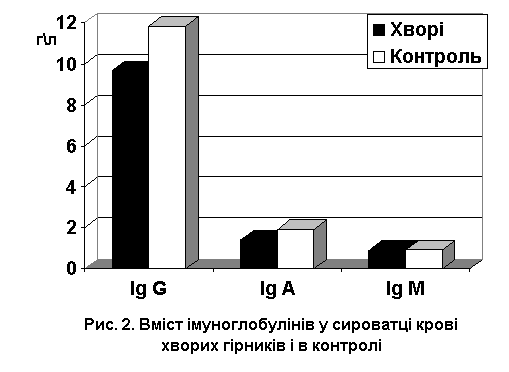
Концентрація
Ig М становила (0,88±0,03) г/л у порівнянні з контролем (0,92±0,04) г/л (kS=0,64,
p=0,523; kF=1,26, p=0,514 відповідно) і не відрізнялась у хворих та здорових
гірників.
В наших дослідженнях можна було виявити
аутосенсибілізацію до антигену головного мозку. У постраждалих виявлено
антитіла до антигену головного мозку (1,35±0,14), які в контролі не
визначались. ЦІК у хворих підвищені до (0,63±0,03) г/л на відміну від
контрольної групи (0,50±0,02) г/л (kS=2,31 p=0,023, kF=2,70 p=0,0062). ЦІК були
прямо пов’язані з тяжкістю стану постраждалих гірників (r=+0,61, p<0,001)
і значна тяжкість отруєння впливала на збільшення рівня ЦІК (kKW=12,67, p=0,0018; c2=9,26, p=0,0097). Таким чином, при гострих гіпоксичних енцефалопатіях
внаслідок отруєння метаном виникають порушення не тільки нервової системи, але
й імунітету, що потребує подальшого його дослідження у постраждалих гірників,
пошуків ефективної імунокоригуючої терапії та подальшої кооперації спеціалістів
різних фахів у реабілітації таких хворих [13].
Висновки:
1. У гірників із гострою гіпоксичною енцефалопатією має
місце зниження фагоцитарної активності нейтрофілів за показниками НСТ-тесту.
2. За результатами дослідження Т-ланки імунітету
встановлено, що в обстежених хворих розвивається Т-клітинний імунодефіцит,
переважно за рахунок зменшення вмісту Т-хелперів та природних кілерів.
3. При гострій гіпоксичній енцефалопатії у постраждалих
гірників має місце порушення гуморальної ланки імунітету за рахунок зменшення
кількості В-лімфоцитів, концентрації імуноглобулінів G, A та аутосенсибілізації до
антигену головного мозку.
Література:
1. Бабаева А.Г. Регенерация и система
иммуногенеза. – М: Медицина, 1985. – 256 с.
2.Бебешко В.Г., Чумак А.А., Базыка Д.А., Беляева Н.В.
Моноклональные антитела в клинической радиационной иммунологии: Метод.рекомендации. – Киев, 1993. – 15с.
3. Головін
Ю.О. Гострі отруєння рудниковим газом у вугільних шахтах // Вестник гигиены и
эпидемиологии. – 2005. - Т.9, №1. – С. 34-37.
4. Головін
Ю.О., Тищенко А.В. Епідеміологія отруєнь рудниковим газом у вугільних шахтах //
Матеріали всеукр.наук.-практ.конф. „Актуальні проблеми клінічної,
експериментальної, профілактичної медицини та стоматології”. – Донецьк, 2005. –
С. 116-117.
5. Головін
Ю.О., Ніколенко В.Ю., Гладчук Є.О. Організація медичної допомоги гірникам
вугільних шахт при отруєннях рудниковим газом // Тези доповідей „Ювелейного VIII зїзду ВУЛТ, присвяченого
15-річчю організації (1990-2005 рр.)”, м.Івано-Франківськ, 21-22 квітня 2005
року // Українські медичні вісті. – 2005. – Т.6, Ч.1-2 (64-65). – С.370.
6. Иммунологические методы / Под ред. Г.Фримеля: Пер. с нем. А.П. Тарасова. – М.:Медицина,
1987. – 472 с.
7. Климов В.В., Кошована Т.В. Тест восстановления
нитросинего тетразолия,
стимулированного пирогеналом // Лаб. дело. – 1982. – №10. – С.48-49.
8.Лабораторные методы исследования в клинике: Справочник / В.В.Меньшиков, Л.Н.Делекторская,
Р.П. Золотницкая и др. / Под ред. В.В.
Меньшикова. – М:Медицина, 1987. – 368 с.
9. Лапач С.Н., Губенко А.В.,
Бабич П.Н. Статистические методы в медико-биологических
исследованиях с использованием Excel. — Киев: Морион, 2000. — 320 с.
10. Лужников
Е.А., Костомарова Л.Г. Острые отравления: Руководство для врачей. – 2-е изд. – М.: Медицина, 2000. – 434 с.
11.Можаев Г.А., Заболотный В.Н., Дьяконов В.Н., Малыш
И.Р. Неотложная медицинская помощь пострадавшим при авариях и катастрофах. – Київ: Здоров’я, 1995. – 272 с.
12.Ніколенко
В.Ю. Хвороби нервової системи в гірників і імунопатологія. – Донецьк:
Донеччина, 1999. – 288 с.
13.Ніколенко
В.Ю., Камков В.П., Новосельська В.В. Головін Ю.О. Кооперація спеціалістів при
реабілітації гірників із шахтними отруєннями // Архив клинической и
экспериментальной медицины. – 2003.
Додаток. – Т.12, №2. – С. 90.
14.Новиков Д.К., Новикова В.И. Клеточные методы
иммунодиагностики. – Минск: Беларусь, 1979. –
222 с.
15.Ellengorn M.J., Barseloux D.G. Medical
Toxicology Diagnosis and Treatment of Human Poisoning. – New York: Elsevier
Sience Publishing Company, 1998. – 566 p.