К.
в. н. Осипова Б. А., д. в. н. Гершун
В. И.
Костанайский государственный университет им. А. Байтурсынова
ХАРАКТЕРИСТИКА
ПОПУЛЯЦИИ ЛИСТЕРИЙ В КАПУСТЕ
Листериоз является широко распространенной
инфекционной болезнью, наносящей значительный ущерб животноводству и
представляющей серьезную угрозу здоровью людей. Сложность борьбы с этой
инфекцией обусловлена особенностями биологии ее возбудителя, наличием большого
числа как патогенных, так и непатогенных штаммов, недостаточной изученностью
генома и антигенной структуры микробных
клеток.
Возбудитель листериоза достаточно устойчивый во внешней среде. При
благоприятных условиях (низких температурах, достаточной влажности) обладает
способностью не только длительно сохраняться, но и размножаться при 4-6°С в
почве, воде, пищевых продуктах (мясе, молоке, овощах, квашеной капусте), в том
числе при хранении продукции в холодильнике.
Необходимо отметить, что листериоз является сапронозной инфекцией, при
которой вегетативные клетки листерий могут переходить в L -формы, а также в
некультивируемое состояние [1].
С целью изучения морфологических свойств
листерий нами изучена жизнеспособность их в стерилизованном соке белокочанной и
краснокочанной капусты при различных температурных режимах. Для этого из проб свежей
белокочанной и краснокочанной капусты, при помощи соковыжималки, получали
капустный сок, который разливали в пробирки, стерилизовали, затем инфицировали
листериями из расчета 150 КОЕ/мл. Пробы сока выдерживали в термостате при
температуре 37°С, при комнатной температуре 18-20°С, в холодильнике при 4°С.
Исследования показали, что при посеве из капустного сока в первые дни
опыта на МПА с налидиксовой кислотой листерии не отличались по своим
морфологическим признакам от исходных штаммов, которые росли в виде колоний S-формы.
Спустя
9-11 суток в посевах из стерилизованных проб сока белокочанной капусты,
хранившихся при 37ºС листерии росли в виде колоний R-формы и их
промежуточных вариантов. Результаты исследований приведены в сводной таблице 1.
Таблица 1
Диссоциация и L-трансформация листерий
в капустном соке при 37°С
(сводные данные)
|
Вид капусты |
Число проб |
Сроки обнаружения, сутки |
|
|
R-формы |
L-формы |
||
|
Стерилизованный
сок белокочанной капусты |
3 |
9-11 |
17-19 |
|
Стерилизованный
сок краснокочанной капусты |
3 |
12-14 |
16-18 |
В последующие сутки в посевах из этих проб
преобладали колонии R-формы,
зачаточные узелки и нити колоний, которые были хорошо видны при
фазово-контрастной микроскопии. Колонии R-формы и зачаточные узелки состояли из нитевидных форм,
длина которых колебалась в пределах 15-300 мкм.
В
стерилизованных пробах сока краснокочанной капусты на 12-14 сутки также отмечался рост колоний R-форм (рисунок 1).
Дальнейший пересев R-форм
сопровождался утратой их и появлением роста только S-формы. В связи с этим появление в данном случае R-форм следует
рассматривать не как истинную диссоциацию листерий, а как результат их
временной модификации. Зачаточные узелки и нити при пересевах не давали роста и
их рекультивировать не удавалось. В аналогичных посевах из проб, хранившихся
при 4-18ºС явление диссоциации не отмечалось.
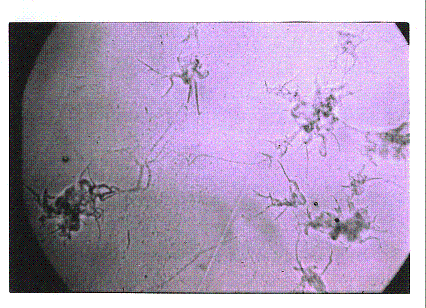
Рисунок 1 - Колонии R-формы листерий (увел.
18)
Таким
образом, в капусте при температуре 37°С спустя 9-12 суток размножение листерий
сопровождалось диссоциацией и появлением в популяции микробных клеток, у
которых процесс формирования колоний прерывается на стадии микроскопически
видимых зачаточных узелков и нитей. По-видимому, зачаточные узелки и нити
колоний являются образованиями микробных клеток в стадии перехода их в
субклеточные формы, которые, как известно не дают роста в виде колоний.
R-формы листерий спустя 11-14 суток не обнаруживались и на
смену им появлялись L-формы.
В посевах из проб белокочанной и
краснокочанной капусты на 14-15 сутки
отмечался рост колоний, которые следует рассматривать как переходную
стадию L-форм. Они имели шаровидную форму с ровными краями и плотным
центром.
Микроструктурные элементы этих колоний состояли из сферических тел,
содержащих вакуоли и гранулы, и были отнесены к М-формам. Это шаровидные тела
разных размеров и разной оптической плотности. Спустя 16-17 суток в посевах из
стерилизованных проб сока белокочанной и краснокочанной капусты отмечался рост
типичных колоний L-форм. Они имели
слизистую консистенцию, нежный, прозрачный, кружевидный край и более плотный,
оптически недифференцируемый центр, врастающий вглубь среды (рисунок 2, 3).
Размеры этих колоний колебались в пределах 0,5-2 мм и они состояли из темных и
белых шаровидных тел разных размеров и разной оптической плотности, нитевидных
и вакуолизированных форм, содержащих включения разнообразных гранул,
субмикроскопических частиц. Клеточное содержимое было зернистым, состоящим из
шаровидных тел и структур, не имеющих определенной формы (рисунок 4).
Явление L-трансформации листерий
в пробах, хранившихся при 4-18ºС не установлено. Таким образом, в процессе
жизнедеятельности листерий в капустном соке при температуре 37ºС
происходит их L-трансформация.
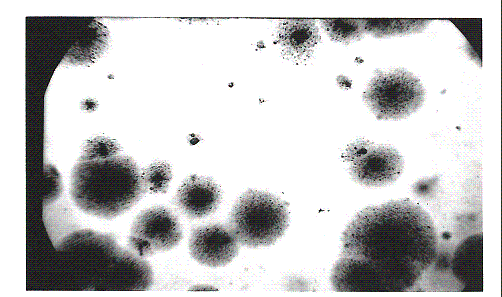
Рисунок 2 - Колонии L-формы листерий.
Фазово-контрастная
микроскопия (увел. 50)

Рисунок 3 - Колония L-формы листерий.
Фазово-контрастная
микроскопия (увел. 308, деталь рисунка 2)

Рисунок 4 -
Микроскопические структурные элементы L-форм листерий.
Фазово-контрастная микроскопия (увел. 1150)
При
1-2-кратном пересеве L-форм
колоний отмечался рост обычных бактериальных колоний, микроструктурные элементы
которых состояли из гигантских клеток, шаровидных или грушевидных тел и иногда
вакуолизированных форм. Таким образом, полученные L-формы листерий были не стабильными и при дальнейших
пересевах на питательных средах, происходила их реверсия.
На основании полученных данных разработан новый способ получения L-форм листерий. С этой
целью белокочанную и краснокочанную капусту и их отходы (листья, нестандартная
капуста) измельчали при помощи мясорубки, помещали в закрытый сосуд или
полиэтиленовые мешочки слоем высотой 2-3 см и выдерживали при комнатной
температуре 3-4 суток. Затем из этой капустной массы при помощи соковыжималки
получали капустный сок, определяли его рН (6,5-7,8) и в дальнейшем готовили
среду по общепринятой методике (разливали в пробирки, стерилизовали и т.д.).
Пробирки со стерильным капустным соком использовали для культивирования
листерий. Через каждые трое суток производили посевы на пластинки МПА,
содержащего 0,004% налидиксовой кислоты. Морфологические, культуральные
свойства листерий изучали при помощи световой и фазово-контрастной микроскопии.
На 15-25 сутки в посевах из опытных проб, хранившихся при 37°С листерии росли в
виде колоний L-формы и их промежуточных
вариантов. В опытных пробах обнаружены методом «раздавленной капли»,
характерные для L-формы колонии, которые
состояли из шаровидных, грушевидных, пузыревидных, вакуолизированных и нитчатых
форм.
Таким образом, при длительном культивировании листерий в капустном соке
в условиях термостата происходит образование L-форм листерий.
Процесс
диссоциации некоторые исследователи рассматривают как ответную реакцию
микроорганизма, возникающую при условиях, неблагоприятных для развития данного
вида. Некоторые ученые рассматривают L-трансформацию
бактерий - как приспособительную (адаптивную) изменчивость микробов, под
влиянием неблагоприятных факторов внешней среды [2,3].
В.И.
Гершун при культивировании листерий в почве, силосе и растительных субстратах
при 18-25°С установил их диссоциацию спустя 21-35 суток и L-трансформацию спустя
4-5 месяцев [3]. Автор не сообщает о диссоциации и L-траснформации листерий при 37°С.
В.А.
Тимаков и Г.Я. Каган считают, что L-форма
бактерий является способом их персистирования – переживания в
неблагоприятных условиях [4].
Согласно нашим данным, в
результате длительного культивирования листерий в капустном соке при 37°С
происходит вначале их диссоциация, а затем L-трансформация. Явление L-трансформации листерий в пробах, хранившихся при
4-18ºС не установлено. На основании полученных данных разработан новый
способ получения L-формы листерий.
Предложенный способ
культивирования листерий позволяет использовать доступное и дешевое сырье
(капусту) для изготовления среды, расширяет диапазон сред, применяемых для
культивирования листерий, позволяет изучить биологические свойства листерий в
новой среде.
Литература:
1.
Жаргалова Т.Т. Идентификация патогенных листерий с помощью полимеразной цепной
реакции. Автореф. канд. дисс. - 2002. -
С. 2-3.
2. Таршис М.Г. Эпизоотологический прогноз и противоэпизоотический
план. - М.: 1979. - С. 43-45.
3. Гершун В.И. Листериоз сельскохозяйственных животных //
Алма-Ата: Кайнар.: 1981. - С. 27-32.
4. Тимаков В.Д., Каган Г.Я. Журн. микробиол. - 1977. - № 4. - С.
3-11.