Наукова конференція:
«Эффективные инструменты
современных наук»
Секція: «Медицина», підсекція
«Организация здравоохранения»
(27.04. – 05. 05. 2009р., Чехія)
Толочко В.М., Шишкіна І.В.
Національний фармацевтичний університет, м. Харків
СТАНОВЛЕННЯ ТА РОЗВИТОК ВІТЧИЗНЯНОЇ
СИСТЕМИ КОНТРОЛЮ ЯКОСТІ ЛІКАРСЬКИХ ЗАСОБІВ
З часів Радянського Союзу існувала
жорстка вертикаль взаємовідносин між установами й організаціями, керівними
органами, в том числі у фармацевтичній галузі, що входили до складу одного
відомства. В повній мірі це торкалось органів контролю якості лікарських
засобів (ЛЗ). На регіональному рівні вони були представлені
контрольно-аналітичними лабораторіями (КАЛ), які створювались аптечними
управліннями. До їх завдань входили:
·
науково-методичне керівництво контролем якості ЛЗ аптечного виготовлення та
продукції, що надходить від постачальників;
·
контроль якості медтоварів, які надходять на аптечні склади і
галено-фасувальні лабораторії;
·
організація внутрішньоаптечного контролю якості ЛЗ та правильного їх
зберігання в аптечних установах;
·
організація, контроль та методичне керівництво роботою
контрольно-аналітичних столів і кабінетів в аптеках;
·
участь у проведенні планових наукових робіт;
·
участь у нарадах, курсах і інших заходах з питань контролю якості ЛЗ.
В аптечних
установах вводяться посади провізорів-аналітиків, які забезпечують контроль
якості ЛЗ на місцях.
Очолювала
систему контролю якості ЛЗ Державна інспекція, яка входила до складу
Міністерства охорони здоров’я (МОЗ) на правах головного управління. Державна
інспекція з контролю якості ЛЗ здійснювала покладені на неї функції як
безпосередньо, так і через Державний науково-дослідний інститут по
стандартизації і контролю якості ЛЗ, КАЛ аптечних управлінь, а також через
відповідні лабораторії, конструкторські бюро промислових підприємств [8].
Нормативно-правове
забезпечення організації контролю якості ЛЗ було сформоване у той же період Радянського
Союзу і діяло на усій його території. Тому на початку 1992 року в Україні не
існувало особистої правової та достатньої технічної бази для регулювання
внутрішнього фармацевтичного ринку і організації відповідного державного
контролю якості ЛЗ. Такий стан на початку формування незалежності України
ускладнювався тенденцією до роздержавлення аптечної мережі, коли значні потоки з
просування ЛЗ почали проходити через недержавний сектор, де ще якість ЛЗ не
гарантувалась.
Для подолання
проблем необхідно було створювати особисту державну систему контролю якості ЛЗ
в Україні. Фактично вона започаткувалась наказом МОЗ України від 15.09.1992 р.
№134 «Про створення Державної інспекції з контролю якості лікарських засобів
Міністерства охорони здоров’я України» [3].
Першими
кроками у формуванні державної системи контролю якості ЛЗ стало відпрацювання
національного переліку заходів, покликаних регламентувати створення, аналіз,
дослідження, впровадження у медичну практику та виробництво ЛЗ. З цією метою
був прийнятий Закон України «Про лікарські засоби» (04.04.1996 р.). Пізніше
підзаконним актом, а саме постановою Кабінету Міністрів України (КМУ) №789 від
02.06.2003 р., у складі МОЗ було утворено урядовий орган – Державну службу ЛЗ і
ВМП. Її завдання полягали у здійсненні контролю за дотриманням законодавства
щодо забезпечення населення і закладів охорони здоров’я якісними, високоефективними,
безпечними та доступними ЛЗ і ВМП, а також надання пропозицій до законодавства
про їх обіг, зберігання, застосування, утилізацію [4,7].
За таких умов
були окреслені конкретні завдання Державної інспекції з контролю якості ЛЗ МОЗ
України. До них увійшли: координація і контроль роботи підпорядкованих
структур; нагляд за обґрунтованістю приписів і рішень стосовно суб’єктів
господарської діяльності (СГД); розробка форм обліку роботи і звітності;
заслуховування звітів; атестація і акредитація КАЛ; державний контроль за СГД і
якістю ЛЗ; вилучення з обігу недоброякісних ЛЗ; інспектування виробників;
узагальнення результатів перевірок; впровадження позитивного досвіду; контроль
за ввезенням ЛЗ на митну територію; оцінка ефективності організації системи контролю
якості ЛЗ; затвердження інструкцій, пропозицій по вдосконаленню, скасуванню або
обмеженню дії чи перегляду стандартів якості; здійснення методичної, інформаційної
і консультативної роботи; атестація фармацевтичних кадрів; участь в розробці
національних програм, планів науково-дослідних робіт; організація проведення
перепідготовки спеціалістів з контролю якості ЛЗ; участь у співробітництві з
Всесвітньою організацією охорони здоров’я (ВООЗ) з питань контролю якості ЛЗ та
інші [12].
Підзаконодавчим
актом стосовно контролю якості ЛЗ слугував також Порядок проведення державної
реєстрації (перереєстрації) ЛЗ, який ухвалений КМУ постановою «Про затвердження
Порядку державної реєстрації (перереєстрації) ЛЗ і розмірів збору за державну
реєстрацію (перереєстрацію) ЛЗ» від 13.09.2000 р. № 1422, яка перезатверджена
Постановою КМУ від 26.05.2005 р. №376 [5,6,14].
Приймається
до уваги й керівництва досвід країн Європейського співтовариства (СЄ), їх
законодавство з питань якості ЛЗ. Серед них, наприклад, Угода про партнерство і
співробітництво між Україною і ЄС (РСА) від 16.06.1994 р., яка була
ратифікована українським парламентом у листопаді 1994 р. і набула чинності з
01.03.1998 р. Головне завдання – привести українську правову базу у
відповідність з правовим полем ЄС.
І вже до 2002
р. діяло 27 територіальних державних інспекцій, Центральна лабораторія з
аналізу якості ЛЗ, загальна кількість співробітників у системі складала біля
600 чоловік, в тому числі 11 кандидатів наук, 331 спеціалістів з вищою освітою.
У якості об’єктів контролю розглядались 5289 СГД, куди увійшло 7949 аптек, 5674
аптечних пунктів, 6400 аптечних кіосків, 1167 складів і 6932
фельдшерсько-акушерських пунктів [3].
На сьогодні
важливим напрямком діяльності державної системи з контролю якості ЛЗ є урахування
вимог належних виробничих і лабораторних практик, у яких передбачено комплекс
заходів щодо створення та підтримки системи забезпечення якості підготовки персоналу,
матеріально-технічного забезпечення, стану матеріально-технічної бази та ін.
[9,11].
Одночасно
необхідно усунути прояви забороненого законом тіньового ринку. Він є частиною
тіньової економіки, що становить собою несанкціоновану господарську діяльність.
Така тіньова діяльність та виробництво й обіг фальсифікованих ЛЗ завдає великих
збитків державі та легальним суб’єктом фармацевтичного ринку. Боротьба з цим
явищем також покладається на державну систему контролю якості ЛЗ, в тому числі
через відповідне законодавче врегулювання [10].
На рівні
регіонів збільшується кількість СГД різних форм власності, зростають для них
складності з економічної, виробничо – господарської діяльності, збільшується
рівень вимог законодавства щодо умов виробництва, виготовлення, оптової та
роздрібної торгівлі ЛЗ, яка поступово адаптується до вимог країн ЄС. Все
вказане потребує подальшого удосконалення системи контролю якості ЛЗ на місцях
[1,2].
Проведені
наукові дослідження звертають увагу на те, що для забезпечення відповідного
рівня та ефективності регіональної системи контролю якості ЛЗ, необхідно
враховувати вплив на неї територіальних чинників. Серед таких чинників
виділяють площу регіону, чисельність проживаючого населення, наявність СГД,
кількість місць реалізації ЛЗ, кількість місць медичного застосування ЛЗ
(лікувально – профілактичні заклади, фельдшерсько – акушерські пункти) та інші
[13].
Для прикладу,
на рис. нами представлені коливання показників цих чинників в межах територіальних
регіонів України. Вони розраховувались як відношення максимального значення до
мінімального (приймалось за одиницю).
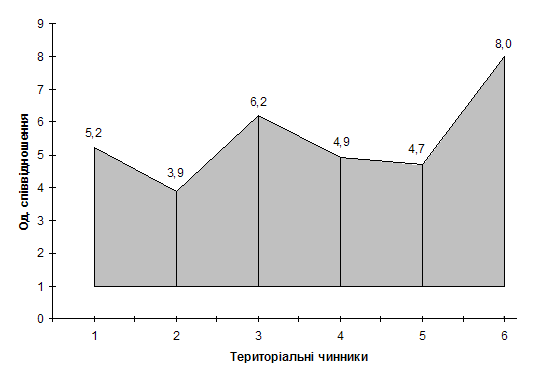
Рис. Коливання показників регіональних чинників, які впливають на територіальну
систему контролю якості ЛЗ: 1 –
населення (млн.): Донецька – Черкаська обл.; 2 – площа (тис. км2): Дніпропетровська і Чернігівська –
Черновіцька обл.; 3 – відстань до м.
Києва : АР Крим – Чернігівська обл.; 4
– кількість СГД: Донецька – Миколаївська обл.; 5 – кількість місць реалізації ЛЗ : Донецька – Тернопільська обл. ;
6 – кількість лікувально –
профілактичних закладів: Донецька – Сумська обл.
Із рис.
видно, що коливання значень територіальних чинників значні. Наприклад, за
чисельністю населення вони співвідносяться як 1:5,2; відстанню до м. Києва як 1:6,2;
кількістю СГД як 1:4,9; кількістю ЛПЗ як 1:8,0. Безумовно, такі коливання мають
враховуватись при організації діяльності територіальних інспекцій з контролю
якості ЛЗ. Так, відстань до м. Києва – це відстань між територіальними
інспекціями і Державною інспекцією з контролю якості ЛЗ, яку кожного разу
необхідно подолати для забезпечення тісного адміністративного та ділового спілкування;
кількість СГД – це обсяг діяльності територіальних інспекцій за кількістю
різних перевірок і так далі.
Висновки. Становлення та розвиток
вітчизняної системи контролю якості ЛЗ беруть початок з часів Радянського Союзу
і продовжують розвиватись разом із розвитком України як незалежної держави.
Ведеться пошук раціональних форм і методів управління нею та організаційної
структури. Головним завданням в цьому - правове їх забезпечення у
загальнодержавному законодавстві, яке має наближатись до такого в країнах ЄС.
Тому,
одночасно, доцільно враховувати закордонний досвід і особливості вітчизняного
фармацевтичного ринку, а також відмінності територіальних регіонів, де
виконуються основні завдання державної системи контролю якості ЛЗ. Вказане,
базуючись на використанні наукових підходів, дозволить правильно поєднати
організаційну систему побудови державного контролю якості ЛЗ з об’єктивним
навантаженням на територіальні підрозділи з контролю якості ЛЗ, врахувати
особливості адміністративних регіонів.
ЛІТЕРАТУРА
1.
Броникова О.Ю. Ведущие украинские фармацевтические произво-дители во глову
угла ставят создание эффективной системы качества лекарственных средств // Провизор.
– 2006. - №13. – С. 8-11.
2.
Бронникова О.Ю. В аптечних учреждениях качество лекарств гарантировано //
Провизор. – 2006. - №13. – С. 3-4.
3.
Варченко В.Г. Сучасний стан контролю якості лікарських засобів в Україні //
Фармація ХХІ століття: Матеріали Всеукраїнської наук.-практ. конф. (23-24.10.
2002 р.) / Редкол.: В.П. Черних, І.С. Грищенко, В.М. Толочко. – Х.: Вид-во
НФаУ; Золоті сторінки, 2002. – С. 216-218.
4.
Герасимчук Т. Система контролю якості лікарських засобів в Україні та
перспективи її розвитку // Ліки України. – 2001. – №11. – С. 12-13.
5.
Диференційований підхід до підготовки фахівців з контролю якості лікарських
засобів у сучасних умовах / С.І. Коваленко, І.А. Мазур, О.М. Авраменко, Л.І.
Бородін // Вісник фармації. – 2001. – №4. – С. 73.
6.
Довідкові матеріали до засідання підсумкової колегії Державної служби
лікарських засобів і виробів медичного призначення за 2004 рік. – К., 2005. –
114 с.
7.
Законодавство України про охорону здоров’я // Міністерство охорони здоров’я України. – Юрінком Інтер, 2000. –
526 с.
8.
Історія фармації України / Р.В. Богатирьова, Ю.П. Сніжанко, В.П. Черних та
ін. – Х.: Прапор, 1999. – 800 с.
9.
Паршина Н.І., Ветютнева Н.О. Системний підхід до удосконалення виробничої
діяльності лабораторії з контролю якості лікарських засобів // Наука і
соціальні проблеми суспільства: медицина, фармація, біотехнологія: Тези
доповідей ІІІ Міжнародної наук.-практ. конфер. – Ч. І. – Х.: Вид-во НФаУ, 2003.
– С. 230.
10. Пашков В.М. Правове регулювання
обігу лікарських засобів. – К.: МОРІОН, 2004. – 160 с.
11. Стратегія захисту світового ринку
від фальсифікованих лікарських засобів. Масштаб проблеми та шлях її вирішення в
Україні / В.Г. Варченко, І.В. Пилипенко, Т.В. Остраниця, С.В. Сур // Наука і
соціальні проблеми суспільства: медицина, фармація, біотехнологія: Тези
доповідей ІІІ Міжнародної наук.-практ. конфер. – Ч. І. – Х.: Вид-во НФаУ, 2003.
– С. 62.
12. Україна. Кабінет Міністрів. Про
затвердження Положення про Державну інспекцію з контролю якості лікарських
засобів Міністерства охорони здоров’я. Постанова від 16.02.1998 р. №179 //
Провізор. – 1998. – №3. С. 2-4.
13. Хмельницька О.А. Удосконалення
організації контролю якості лікарських засобів на регіональному рівні //
Авотреф. дис. … канд. фармац. наук. – Х.: НФаУ, 2007. – 21с.
14. Юридичні аспекти фармації //
Спеціальний випуск журналу «Провізор». – Х., 2001. – 716 с.