6.
Біологічні науки / Мікробіологія
Д.В. Сидоренко, О.І. Сідашенко, О.С. Воронкова, А.І. Вінніков
Дніпропетровський національний
університет імені О. Гончара
БІОПЛІВКА ЯК СПЕЦИФІЧНА ФОРМА ІСНУВАННЯ
МІКРООРГАНІЗМІВ
До
кінця минулого століття, мікробіологія розвивалася головним чином на основі
досліджень чистих культур мікроорганізмів. Сьогодні проблема біоплівок стає все
більш актуальною, так як у розвитку
та
прогресуванні багатьох захворювань абсолютно доведено участь і велику
патогенетичну роль саме мікробної біоплівки [4]. На даний момент накопичено велику кількість
інформації про їх структуру та розвиток.
Ефективною формою існування мікроорганізмів
є прикріплення до твердої поверхні, у порівнянні із вільним способом життя.
Мікроорганізми, асоційовані на твердій поверхні, організовані в так звані
біоплівки (biofilm), збалансовані за видовим складом і
функціональним розподілом членів спільноти [12].
Біоплівки можуть формуватися на будь-якій
поверхні, як біогенного, так і абіогенного походження. Більш того, не існує
жодного виду бактерій, який не здатний формувати біоплівку. Біоплівкою
називають мікробну асоціацію, при якій бактерії локалізовані на будь-якій
поверхні всередині складноорганізованого екзогенного матриксу, що має білкову
або полісахаридну природу [9].
Біоплівки можуть виявитися дуже
небезпечними. Хвороба легіонерів, яка забрала життя 29 людей у Філадельфії у
1976 р., виявилася пов'язаною з бактеріями біоплівки, що утворилася в системі
кондиціонування повітря [12].
У той же час сучасна біотехнологія успішно використовує оптимальні
співтовариства мікроорганізмів для виконання певних функцій. Це актуально у
виробництві харчових продуктів, ліків і добавок, для утилізації різного роду
відходів, нейтралізації забруднень води нафтопродуктами, застосовують для
знезараження відпрацьованих і стічних вод. Такі спільноти називають іноді
консорціумами мікроорганізмів. Практика показала багаторазове збільшення
ефективності роботи мікроорганізмів при такій організації [10].
Самі бактерії становлять 5-35% маси біоплівки, інша частина -
міжклітинний матрикс. Матрикс найчастіше складається з екзополісахариду.
Наприклад у P. aeruginosa – це
альгінат. Матрикс пронизаний каналами, по яких циркулюють поживні речовини,
продукти життєдіяльності, ферменти, метаболіти і кисень [13].
Метою нашої роботи було проаналізувати наукові джерела, що присвячені
питанням утворення та стійкості мікробних біоплівок до впливу різних речовин.
Етапи
формування біоплівок.
Формування біоплівок – це складний комплексний динамічний процес, що
складається з декількох етапів: адгезії клітин до поверхні та перерозподілу
клітинної маси; активного поділу клітин для створення клітинних кластерів;
утворення екзополімерного слизового матриксу.
Формуванню біоплівки передує процес спрямованого руху бактерій до
поверхні, який здійснюється завдяки наявності у мікроорганізмів хемо- або магнітотаксису.
Основою таксису є сума тактильних сигналів, що отримує клітина від рецепторів,
які змінюються за допомогою спеціальних метилакцептувальних білків,
локалізованих у периплазмі чи цитоплазматичній мембрані. Потім настає адаптація
та прийом сигналу таксису базальним тілом джгутика, внаслідок чого відбувається
реверсія напрямку крутіння останнього і зміна напрямку руху клітин.
Початковим етапом формування біоплівки є адгезія клітин до поверхні та
її колонізація, при чому мікроорганізми адгезуються до поверхні після стадії їх
модифікації. Цей процес проявляється у різний спосіб: накопичення на
твердій поверхні глікопротеїнів, або в утворенні шару, який складається з інших
органічних та неорганічних речовин. Згідно з даними деяких авторів після адгезії
різних видів клітин до поверхні (P.aeruginosa,
V.choleraе, E.coli), відбувається вибіркова експресія більше ніж у 10 %
геному клітин біоплівки порівняно з клітинами планктону [7, 8].
Другий етап формування біоплівки характеризується колонізацією
поверхні. Колонізація поверхні клітинами та наступне формування біоплівки
контролюється такими факторами, як гідродинаміка, хімія поверхні, фізіологія та
генотип клітин.
Подальшим етапом формування біоплівки є утворення мікроколоній
клітин завдяки екзополімерного матриксу. Мікроколонії представляють собою
агрегати, що сформовані бактеріями на поверхні. Як показали дослідження деяких
авторів, саме екзополімерний матрикс має вирішальну роль у формуванні
біоплівкової структури, скріплюючи клітини біоплівки, формуючи порожнини та
захищаючи мікроорганізми від впливу зовнішніх факторів. На наступному етапі
формування, мікроколонії біоплівки утворюють макроколонії – більш агреговані і
складні за структурою.
На рис. 1 а зображено початкові стадії утворення біоплівки,
формування якої починається з
прикріплення вільноплаваючих мікроорганізмів, так званих планктонних клітин до
поверхні.
Перші клітини спочатку прикріплюються до поверхні за рахунок
слабких Ван-дер-Вальсівських сил. Потім утворюються так звані додаткові
(селективні) центри приєднання до поверхні, що формуються за рахунок поділу
клітин або мікроколоній, які приєдналися першими. Перший шар мікроорганізмів
полегшує приєднання інших клітин, забезпечуючи для них різні центри адгезії
(локалізації). Починається утворення позаклітинної матриці, яка утримує
біоплівку (рис.1,б). Деякі види не можуть прикріплюватися до поверхні
самостійно, але можуть прикріплюватися до матриці або безпосередньо до перших
прикріплених мікроорганізмів.
Екзополімерні комплекси можуть
представляти собою різноманітні утворення залежно від характеру призначення:
капсульні; біоплівкові; ті, що вивільняються у поживне середовище [11].
Безпосередньо капсульні полімери відіграють важливу роль захисту клітини від
висихання та атаки фагів. Подібні полімери можуть містити полісахариди, білки,
ліпіди, нуклеїнові кислоти.
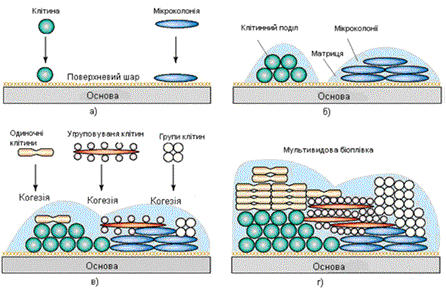
Рис. 1. Початкові етапи утворення
біоплівки: а — прикріплення перших клітин; б — утворення центрів прикріплення;
в — адгезія наступних клітин; г — утворення зрілої багатошарової плівки
На даний момент є загальноприйнята модель біоплівки. За цією моделлю
біоплівка складається з грибоподібних утворень, що включають мікроколонії,
екзополімерний матрикс, крізь який проходять наповнені рідиною канали. Ця
модель узгоджується з результатами електронномікроскопічних методів
дослідження.
Стійкість
до антибіотиків.
Відомо, що антибіотики є основним засобом в боротьбі з інфекційними
захворюваннями. Мікроорганізми, які входять до складу біоплівки менш чутливі до
дії більшості антибіотиків та інших біоцидних речовин, до факторів імунного
захисту макроорганізму, а також більш стійкі до змін температури, рН
середовища, осмотичного тиску порівняно з планктонними культурами. Нині відбувається
інтенсивне вивчення причин такої дивовижної стійкості до антибіотиків у
бактерій біоплівок. Встановлено, що в основі підвищеної виживаємості лежать
властивості клітин і позаклітинного матриксу. Матрикс біоплівки може зв'язувати
або не пропускати, або інактивувати антибіотики [5] Стійкість, обумовлену
властивостями клітин біоплівки, пояснюють зменшенням їх вільної поверхні за
рахунок контактів один з одним і формуванням особливих бактерій, що дістали
назву персистерів. Персистери в силу диференціювання тимчасово стають стійкі
практично до усіх антибактеріальних препаратів. Основними механізмами підвищення стійкості бактерій до
антибіотиків у біоплівках є:
• обмеження живлення і зміна
мікросередовища у біоплівці призводять до зменшення швидкості ділення бактерій,
внаслідок чого залишається менше мішеней для дії антибіотиків;
• адаптивні реакції;
• генна мінливість у персистуючих у
біоплівці бактерій.
Антибіотики за дією на бактерії біоплівок розділяються на два
типи. До першого відносять антибіотики, які проникають у біоплівки і
пригнічують або руйнують мікроорганізми, що утворюють їх. Другий тип –
антибіотики, практично не проникаючі у біоплівки, але що ефективно
перешкоджають їх розселенню за рахунок мігруючих бактерій.
Таким чином, деякі антибіотики не проникають у біоплівки і не
знищують існуючі співтовариства, а тільки перешкоджають збільшенню їх числа і
поширенню в організмі людини. У зв'язку з цим останніми роками почалося
вивчення здатності антибіотиків проникати у біоплівки різних мікробів.
Встановлено, що у біоплівці Klebsiella
pneumoniae погано проникає ампіцилін, а в співтовариства Enterococcus faecalis – ампіцилін,
котримаксозол і ванкоміцин. У біоплівки ряду мікробів погано проникає широко
використовуваний амоксицилін .
До числа антибіотиків, добре проникаючих через ліпіди клітин
відносяться фторхінолони. Ця група антимікробних препаратів здатна діяти на
основні збудники урологічних захворювань, в достатній концентрації проникають в
осередок інфекції. Досвід використання антибіотиків свідчить, що з клінічними
проявами інфекційного процесса можна впоратися за допомогою антибіотиків, які
як проникають, так і не проникають у біоплівки. Проте різниця між ними існує і
вона досить істотна [6].
Мікроорганізми у біоплівках стійкіші порівняно з планктонними культурами
до впливу різних стресових факторів: лімітації субстратів, зміни рН, окисненню
активними формами кисню. При формуванні біоплівки, що складається з
екзополімерних речовин, бактерії отримують додатковий захист від біоцидів,
антибіотиків, антитіл, поверхнево активних речовин, бактеріофагів, фагоцитів,
ультрафіолетового випромінення, висушування. Вважається, що такі структуровані
співтовариства є засобом захисту мікроорганізмів від стресових умов. [1]
Заключення
Аналіз наукових джерел, присвячених питанням утворення та стійкості до
впливу різних речовин мікробних біоплівок, дозволяє стверджувати, що
мікроби-асоціанти відіграють важливу роль в етіології і патогенезі інфекційних
хвороб.
Здатністю до плівкоутворення є додатковим фактором патогенності різних
видів . Відомо, що мікроорганізми, які здатні до плівкоутворення мають
додаткові гени та є носіями плазмід,
які роблять їх стійкими до більшості антибіотиків. Структура біоплівки включає
власне клітини плівкоутворюючого штаму та міжклітинний матрикс. Між клітинами
біоплівки встановлюються контакти за допомогою хімічних речовин – медіаторів.
Міжклітинний матрикс представлений полісахаридами та білками, що зумовлюють
в’язкість середовища, в якому концентруються клітинні угрупування [2,
3].
Для інфекції, зумовленої плівкоутворюючими штамами патогенних та
умовно-патогенних мікроорганізмів, характерний атиповий перебіг, недостатня
ефективність антибіотикотерапії і нерідко перехід в хронічну форму або
носійство. Тому вивчення утворення, структури та регуляції біоплівок є одним із
найважливіших питань при вирішенні проблем, які пов’язані зі здоров’ям людини.
Перелік посилань:
1. Адрианов Н.В.
Биологическое действие ультрафіолетового излучения. «Электронная медицина»
2007.
2.
Белоусов Ю.Б. Устойчивость клинических штаммов коагулазоотрицательных
стафилококков / Ю.Б. Белоусов, С.М. Шатунов // Клин. фармакология и терапия. –
1994. – № 3. – С. 58–61.
3.
Генноопосредованая устойчивость к антибиотикам / О.А. Кондрапова, А.С. Ещина, Н.Ф.
Дмитриева [и др.] // Антибиотики и химиотерапия. – 1998. – №7. – С. 26–30.
4. Ильина Т.С.
Биопленки как способ существования бактерий в окружающей среде и организме
хозяина: феномен, генетический контроль и системы регуля-ции их развития / Т.С.
Ильина, Ю.М. Романова, А.Л. Гинцбург // Генетика. – 2004. – № 40. – С. 1–12.
5. Николаев
Ю. А., Плакунов В. К., Биопленка — «город микробов» или аналог многоклеточного
организма?, Микробиология, 76(2), 2007, С. 149—163
6. Сидоренко С.В. Роль бактериальных биопленок в
патологии человека // Инфекции в хирургии. 2004. Т. 2. № 3. С. 16-20.
7.
Смирнова Т. А., Диденко Л. В., Азизбекян Р. Р., Романова Ю. М.,
Структурно-функциональная характеристика бактериальных биопленок,
Микробиология, 79(4), 2010, С. 435—446
8.
Тец В.В. Бактериальные сообщества. // Клеточные сообщества / под ред. В.Теца.
СПб.: Изд-во СПб ГМУ,1998.С. 15-73.
9.
Donlan R.M., Costerton J.W. Biofilms: survival mechanisms of clinically
relevant microorganisms. Clinical Microbiology Reviews 2002; 15(2): 167—193.
10.
Carpentier B.
Biofilms and their
consequences, with particular reference to
hygiene in the
food industry / В. Carpentier, О. Cerf // J. Appl.
Bacteriol. – 1999. — Vol. 75, N. 6. – Р. 511.
11.
Costerton, J.W. Microbial biofilms / J.W. Costerton [et al.] // Ann. Rev.
Microbiol. – 1995. – Vol. 49. –P. 711–745
12.
Garth A. I. Biofilm in chronic wounds // Wound. Rep. Reg. – 2008 – Vol. 3, N.
4. – P. 26–28.
13. Tetz
V. V. The
effect of antimicrobial agents and
mutagen on bacterial cells in
colonies // Med. Microbiol.
Lett . – 1999. – N. 5. – P.
426—436 .