Химическая технология /5
канд. техн. наук, доц. Фомин А.А.1, докт. техн. наук, проф.
Родионов И.В.1, студ. Фомина М.А.1, канд. физ.-мат. наук Захаревич А.М.2,
канд. физ.-мат. наук Скапцов А.А.2, канд. вет. наук, доц. Красников А.В.3, м.н.с.
Петрова Н.В.2, асп. Грибов А.Н.2, студ. Аткин В.С.2
1 Саратовский
государственный технический университет
имени Гагарина Ю.А., Россия
2 Саратовский
государственный университет
имени Н.Г. Чернышевского, Россия
2 Саратовский
государственный аграрный университет
имени Н.И. Вавилова, Россия
Исследования проведены при
поддержке гранта РФФИ
№ 13-03-00898.
Структура и свойства
оксидных покрытий из нанокристаллического рутила, модифицированного коллоидными
наночастицами гидроксиапатита
Введение
Современная
травматология, ортопедия, восстановительная и челюстно-лицевая хирургия
предполагают использование биосовместимых металлических материалов, например,
технически чистого титана (ВТ1-00) и сплавов на его основе (ВТ16). Титановые
сплавы востребованы при изготовлении элементов эндопротезов крупных суставов,
искусственных корней зубов – дентальных имплантатов, а также остеофиксаторов
[1]. Поверхность данных медико-технических изделий должна характеризоваться
особым набором физических, химических, биомеханических и эксплуатационных
характеристик. Прочная титановая основа обеспечивает сопротивление механическим
распределенным нагрузкам, однако при имплантации (установке) в кость с
необходимым натягом (превышением диаметра имплантата по отношению к диаметру
костного канала) возникают усилия среза. Это приводит к интенсивному износу
(царапанием о твердые участки кортикальной костной ткани) и снижению качества
биоактивности поверхностного слоя имплантата, остеофиксатора или внутрикостной
части эндопротеза. В данных экстремальных условиях на первый план выходят и
прочностные характеристики поверхностного слоя. При условии сохранения
конструктивной целостности данных изделий, в том числе их поверхностного слоя в
виде биосовместимого покрытия, особое внимание уделяется интенсификации остеоинтеграционных
процессов за счет повышения морфо-геометрических показателей:
- микрометровых
значений элементов шероховатости и нанометровых – для субшероховатости [2, 3];
- пористости, в том
числе открытого типа.
Обработка
поверхности медико-технических металлических изделий обычно производится
плазменным напылением, вакуумно-конденсационными методами осаждения тонких
пленок или газотермическим оксидированием [4, 5]. Отличительными чертами
данных методов являются значительная энергоемкость, необходимость использования
сложной технологической последовательности, дорогостоящих материалов, больших
производственных площадей, относительно большая длительность процесса получения
функционального слоя, сниженная прочность и трещиностойкость при высоких значениях
пористости, а также ограниченность или отсутствие возможности получения
нанокристаллической и нанопористой структуры. В связи с указанным выше целью исследований является разработка
технологии формирования биоактивных прочных покрытий с развитыми морфо-геометрическими
параметрами микроструктуры и однородностью наноструктуры за счет обработки
токами высокой частоты (ТВЧ) и модификации коллоидными наночастицами ГА –
гидроксиапатита кальция Ca10(PO4)6(OH)2.
Методика эксперимента
Образцы представляют собой тела вращения из технически чистого титана ВТ1-00, а также сплава ВТ16. Поверхностный слой этих изделий подвергается пескоструйной обработке корундовым абразивом и очистке в ультразвуковой ванне. Поверхность подготовленных образцов оксидируется в воздушной среде при воздействии ТВЧ. Далее производятся модификация коллоидными наночастицами ГА и завершающая (стабилизирующая) индукционно-термическая обработка (ИТО). Устанавливается влияние ИТО в диапазоне температуры 600…1200 °C на структурные показатели покрытий, а также механические свойства (твердость и стойкость к царапанию).
При исследовании структурного состояния покрытий применялись методы рентгенофазового анализа (РФА) на дифрактометре Gemini/Xcalibur и растровая электронная микроскопия (РЭМ) на электронном микроскопе MIRA II LMU. Механические свойства определялись наноиндентированием, позволяющим исследовать твердость тонкослойных покрытий при малой нагрузке, прикладываемой к алмазному индентору Берковича, и скретч-тестированием, выявляющим характер разрушения покрытий, на тестере механических свойств NANOVEA. Метод скретч-тестирования также позволяет определить коэффициент трения в зависимости от глубины проникновения индентора и соответствующей величины нормально ориентированной нагрузки. Медико-биологические исследования образцов остеофиксаторов с покрытиями оценивали in vivo на опытных животных (кроликах породы Серый великан) при непродолжительном сроке тестирования, составляющем 30 суток. Образцы покрытий нумеровали в соответствии с величиной температуры ИТО, например, 06 – 600 °C.
Результаты исследования и их анализ
Результаты РЭМ поверхности образцов показали
наличие композиционной пористой структуры оксидной матрицы покрытия,
модифицированной наночастицами ГА (рис. 1). Микроструктура поверхности
представляет собой рельеф исходной титановой основы после подготовительных
операций и получения оксидного матричного покрытия рутила TiO2 (рис. 1 a). Исследование в
нанометровом масштабе позволяет выявить тонкую структуру, представленную
округлыми зернами, их агломератами и мельчайшими порами (рис. 1 c, 1 d). Каркас такой композиционной структуры
образует оксидная матрица TiO2, в поры которой
внедряются наночастицы ГА. При этом поверхностный слой субмикрометровых и
микрометровых выступов, а также пор равномерно покрыт тончайшим слоем
наночастиц ГА средним размером 30…50 нм, образующихся при режимах 06 и 08 (рис. 1 b, 1 c). Увеличение температуры ИТО до 1000…1200 °C способствует коалесценции наночастиц с
образованием слоистой пористой структуры, при этом размер пор находится в
широком диапазоне от 50 до 500 нм (рис. 1 d).

Рис. 1. Морфология микро- (a, b) и наноструктуры (c, d) композиционных
покрытий «TiO2 + нано-ГА», полученных при режиме ИТО 08 (a-c) и 12 (d)
Оксидные покрытия TiO2 и композиционные «TiO2 + нано-ГА» характеризуется определенными механическими свойствами, в частности, твердостью (рис. 2).
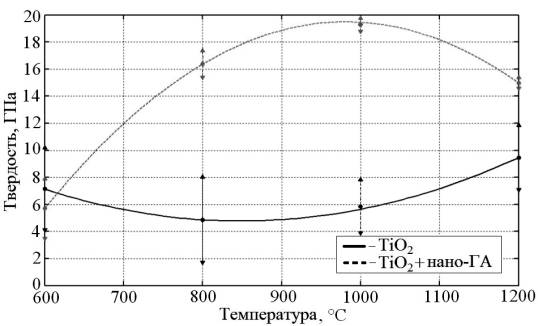
Рис. 2.
Зависимости твердости биосовместимых покрытий
от температуры
ИТО
Зависимость твердости покрытий оксидных покрытий TiO2 носит параболический характер. Минимальные показатели твердости для оксидных покрытий соответствуют диапазону 840…870 °C, что может объясняться фазовым переходом α-Ti ↔ β-Ti в металлической основе. Повышение твердости в высокотемпературной области обеспечивается при условии ограниченного доступа кислорода воздуха [6]. Полученные значения твердости характеризуют данные покрытия как высокопрочные, о чем свидетельствуют данные, в 8…15 раз превышающие твердость кортикальной костной ткани.
Твердость композиционных покрытий «TiO2 + нано-ГА», полученных при режиме ИТО 06 характеризуется трехкратным возрастанием до 6 ГПа по сравнению с титановой основой. При режиме ИТО 10 твердость достигает максимальных значений и составляет около 20 ГПа, что почти на порядок превышает твердость титана ВТ1-00.
Повышенные значения твердости коррелируют с высокой стойкостью к царапанию, что наглядно иллюстрируется данными скретч-теста (рис. 3).
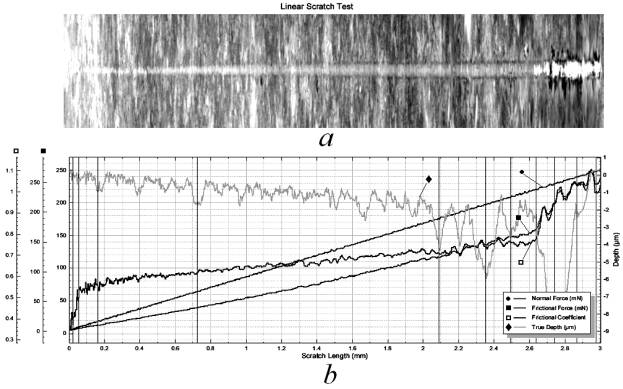
Рис. 3. Результат
скретч-тестирования образца ИТО 10: a – царапина; b – диаграмма изменения показателей (нормальной
нагрузки – ●; силы
трения – ■;
коэффициента трения – □;
глубины внедрения индентора – ♦)
На типовой диаграмме указаны параметры теста, в частности, осевая нагрузка, прикладываемая к индентору (рис. 3 b). Исходя из представлений о геометрии индентора, рассчитаем механические напряжения, возникающие при разрушении. Согласно данным микроскопии царапины, возросшему коэффициенту трения с 0,6 ± 0,1 до 0,9 ± 0,1 на участке нормальной нагрузки 220 мН, глубины проникновения индентора 2 мкм и нагрузки 230 мН, глубины проникновения 9 мкм, получаем следующие параметры прочности: предел прочности при скретч-тестировании покрытия 1,75 ГПа и остаточное сопротивление после разрушения покрытия, равное 0,4 ГПа, характеризует ниже лежащий материал металлической основы – титан. Таким образом, по результатам скретч-тестирования отмечается высокая стойкость покрытий к царапанию.
Предварительные испытания in vivo позволяют оценить высокий остеоинтеграционный потенциал остеофиксаторов с экспериментальными покрытиями TiO2 и композиционными «TiO2 + нано-ГА» (рис. 4).

Рис. 4.
Остеофиксаторы с покрытиями: a – общий вид;
b – костный регенерат (между витками); c – костные структуры
Высокие морфо-геометрические показатели нанокристаллической структуры поверхностного слоя таких имплантационных конструкций, а также значительные показатели физико-механических характеристик биоактивных покрытий способствуют стабильному закреплению костной ткани даже на ранних постоперационных этапах приживления (рис. 4 b). Подтверждением выдвинутого положения служат данные РЭМ в сочетании с энергодисперсионным анализом химического состава тканевых фрагментов, расположенных на поверхности остеофиксаторов после испытания in vivo (рис. 4 c). Морфология оксидных покрытий после испытаний характеризуется наличием кальция, фосфора – основных химических элементов минеральной составляющей кости. Причем распределение этих элементов по поверхности коррелирует с расположением углублений и пор.
Выводы
Обработка ТВЧ титановых медицинских изделий и последующее модифицирование оксидной матрицы коллоидными наночастицами ГА при воздействии ИТО обеспечивает ускоренное образование на поверхности механически прочной композиционной структуры. Результаты исследования и анализ влияния режимов ИТО на морфологию служат основанием для разработки технологических рекомендаций по модификации поверхности медико-технических изделий из титана и его сплавов, например, внутрикостных имплантатов, эндопротезов и остеофиксаторов. Установлено, что тонкослойное пористое оксидное покрытие, модифицированное наночастицами ГА керамики, формируемое при нагреве от 800 до 1200 °C и выдержке не более 300 сек, характеризуется высокой биоактивностью, твердостью и стойкостью к царапанию.
Литература
1. Paital S.R., Dahotre N.B. Calcium phosphate
coatings for bio-implant applications: Materials, performance factors, and
methodologies // Materials Science and Engineering R, 2009. – №. 66. – pp. 1–70.
2. Fomin
A.A. et al. Nanocrystalline structure of the surface layer of plasma-sprayed
hydroxyapatite coatings obtained upon preliminary induction heat treatment of metal base // Technical Physics Letters, 2012. – Vol. 38.
– №. 5. – pp. 481–483.
3. Myshkin N.K., Petrokovets M.I., Chizhik S.A. Basic problems in contact characterization at nanolevel // Trib. Int., 1999. – Vol. 32. – №7. – pp. 379–385.
4. Родионов И.В. Исследование паротермических оксидных покрытий
на медицинских титановых имплантатах // Медицинская техника, 2012. – № 2 (272).
– С. 16–20.
5. Родионов
И.В. Физико-химические и механические свойства функциональных термооксидных
покрытий на медицинских имплантатах из нержавеющей стали // Физики и химия
обработки материалов, 2012. – № 4. – С. 45–52.
6. Фомин А.А., Штейнгауэр А.Б., Родионов И.В., Анников В.В.,
Петрова Н.В., Захаревич А.М., Грибов А.Н. Нанометровые характеристики
морфологически гетерогенных биосовместимых покрытий, получаемых на титане при
воздействии токов высокой частоты // Гетеромагнитная микроэлектроника, 2012. –
Вып. 13. – С. 57–63.