д. т. н. Корнієнко Я. М.,
Мартинюк О.В.
Національний технічний університет України
«Київський політехнічний інститут», Україна
Кристалізація розчинів сульфату амонію
при наявності органічних домішок
Існуюча технологія
одержання крупнокристалічного сульфату амонію передбачає часткове відведення
маточного розчину з кристалізаторів, з великим вмістом органічних речовин ,
який накопичується у сховищах. Цей розчин містить біля 0,01% циклогексанону,
0,15% капролактаму та 0,1% трихлоретилену, що підвищує ризики екологічної
небезпеки виробництва [1,2].
Для розроблення екологічно безпечного способу утилізації
розчинів сульфату амонію необхідно провести дослідження процесу кристалізації
сульфату амонію з рідких систем з органічними домішками, що є актуальними.
Постановка задачі:
Метою досліджень є визначення впливу органічних домішок
на кристалізацію водних розчинів сульфату амонію виробництва капролактаму.
Вміст органічних домішок визначався через хімічну потребу
кисню ХПК (О2/дм3). pH розчину змінювалось в межах 3,5 ÷ 4,4.
Контрольний розчин одержано шляхом розчинення у воді
кристалічного сульфату амонію з ХПК = 3000 мг О2/дм3 та рH =3,5.
Дослідження процесу кристалізації розчинів, з різним вмістом органічних
домішок, проводились за нормальних умов
t=20 C° та P=760 мм рт ст, на предметних скельцях. Одержані зразки вивчались за допомогою
мікроскопа із 36-кратним збільшенням,
та фотографувались, з подальшою цифровою обробкою. Достовірність результатів
підтверджена 20 – кратним повторенням для кожного розчину та визначенням
найбільш типових зразків, які наведені на рис. 1.
251658240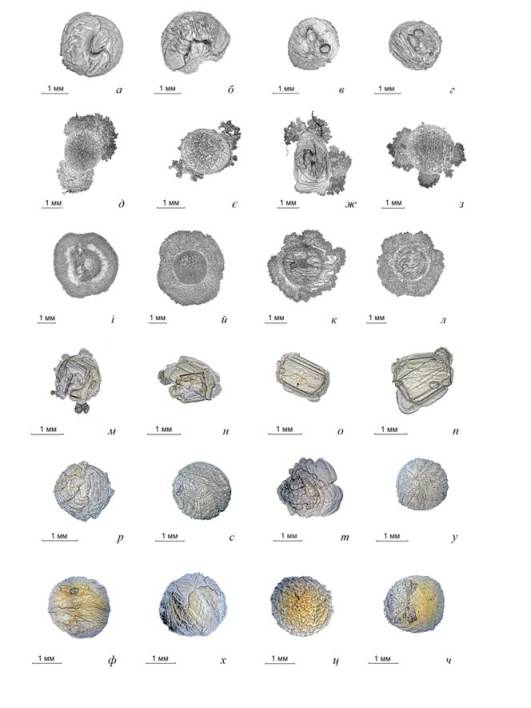
Рис. 1 Фотографії
кристалізації насичених водяних розчинів сульфату амонію з різним вмістом
органічних домішок, збільшення ×36 :
а, б, в, г - ХПК = 3000 мг О2/дм3 ; м, н, о,
п - ХПК = 56806 мг О2/дм3;
д, є, ж,
з - ХПК = 20656 мг О2/дм3 ; р, с, т, у - ХПК = 92951 мг О2/дм3;
і, й, к,
л – ХПК = 31962 мг О2/дм3 ; ф, х, ц,
ч - ХПК = 241297 мг О2/дм3.
На рис. 1 а, б, в
та г наведені фотографії мікрокристалів сульфату амонію, отримані
з контрольного розчину з ХПК = 3000 мг О2/дм3. Кожен з
цих зразків являє собою кластер, утворений із прозорих мікрокристалів, в межах
площі, яку займала крапля початкового
розчину. З огляду на форму зразків а та б
кристалізація здійснювалась з одного напрямку. У випадку зразків в
і г, кристалізація відбулась з усіх напрямків, що призвело до
появи пустот у кристалічному кластері.
Тобто ізотермічна кристалізація відбувається у всьому
об’ємі нанесеного розчину і дифузійний опір процесу, зумовлений наявними
органічними домішками є незначним. За межами краплі початкового розчину не
спостерігається утворення дендритних відгалужень. Поверхня утворених кристалів
сульфату амонію є повністю відкритою.
У випадку реального розчину з ХПК = 20656 мг О2/дм3, що майже у 7 разів
перевищує попередній, на рис. 1 д,є,ж,з,
спостерігається наявність мікрокристалів із значно меншими лінійними розмірами,
ніж у попередньому випадку, та утворення за межами краплі початкового розчину
областей дендритних відгалужень. Багатократне збільшення вмісту органічних домішок призводить до
підвищеного дифузійного опору в центрі краплі досліджуваного розчину порівняно
з її периферією. При цьому у центрі краплі спостерігається збільшення кількості
органічних речовин, яка частково закриває поверхню мікрокристалів, а центри
майбутньої кристалізації утворюються за межами площі краплі початого розчину, у
зоні дендритних відгалужень. Зміна
кольору мікрокристалів не спостерігалась.
При подальшому збільшенні вмісту органічних речовин до
ХПК = 31962 мгО2/дм3, рис.1 і, й,
к та л, зростає дифузійний опір в центрі. Внаслідок
цього навколо краплі початкового розчину, утворюється щільний ореол із
дендритних утворень. Площа цих утворень майже у 2 рази перевищує початкову
площу краплі досліджуваного розчину. Це зумовлюється значним збільшенням
дифузійного опору в центрі краплі, що призводить до експансії молекул сульфату
амонію через зовнішній периметр площі, яку займала початкова крапля. Утворення
друз та дендритів за межами краплі сприяє утворенню мікрокристалів з відкритою
поверхнею, яка слугуватиме новими центрами кристалізації, в разі повторного
нанесення робочих розчинів. Зразки прозорі, забарвлення відсутнє.
В розчині з ХПК = 56806 мг О2/дм3
, рис. 1 м, н, о, п
спостерігається утворення мікрокристалів в середині краплі без наявності
дендритних відгалужень за її межами.
При цьому на поверхні кристалів утворюється щільна плівка органічних
домішок жовтуватого кольору, що призводить до мінімізації вільної поверхні
кристалів, та унеможливлює побудову
кристалічного каркасу.
Збільшення вмісту органіки
до ХПК = 92951 мг О2/дм3
рис. 1 р, с, т, у та
ХПК=241297 мг О2/дм3 рис. 1 ф, х,
ц, ч підтверджує припущення, щодо утворення
щільного шару органіки на поверхні кристалів. Це пов'язано з тим, що органічні
речовини знаходяться в емульгованому стані, і при повільному видаленні
розчинника, осаджуються на поверхні кристалів. Плівка органічних речовин стає
щільнішою та набуває жовто-коричневого кольору. Цей процес спостерігається в
умовах коли швидкість видалення розчинника значно менша швидкості утворення
кристалів сульфату амонію, на форму яких впливає дифузійний опір домішок.
Висновки.
Дослідним шляхом
встановлено, що у випадку проведення процесу кристалізації в дифузійній області
розчинів сульфату амонію з органічними домішками, що знаходяться в емульгованому
стані, максимальне допустиме значення вмісту органічних домішок з ХПК = 50000 мг О2/дм3.
В цьому випадку існує достатня кількість вільної поверхні мікрокристалів, на
якій ітераційним способом можливо проводити пошарову кристалізацію розчинів та
утворення, в подальшому, каркасу із мінеральних солей.
Література
1. Лазорин С.Н.,
Стеценко Е.Я. Сульфат аммония. – М.: Металлургия, 1973. – 386 с.
2. Производство
капролактама А.С. Бадриан, Ф.Г. Конулин. Под ред. В.И. Овчинникова, В.Р. Рудчинского – М.: Химия, 1965 – 168 с.