А. А. Воробьева
Харьковский национальный автомобильно-дорожный университет
АДСОРБЦИЯ
МЕТАЛЛУРГИЧЕСКИМ ШЛАКОМ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
Изучена адсорбция низкомолекулярных
ароматических соединений на сорбенте, представляющем собой металлургический
шлак Побужского ферроникелекого комбината производства сплава FeNi. В качестве сорбатов
выбраны наиболее распространенные загрязнители сточных вод предприятий
ряда отраслей промышленности: фенол, п-нитрофенол,
анилин и п-нитроанилин. Одной из
причин адсорбции плоских молекул
ароматических производных бензола на гидроксилированной поверхности кремнеземов
являются водородные связи π-электронов бензольного кольца с поверхностными
силанольными группами. Адсорбцию проводили в статическом режиме в течение 3
суток. Концентрации соединений в растворе определяли методом газовой
хроматографии. Согласно результатам адсорбции
(таблица 1) ароматические соединения можно расположить в ряд увеличения
эффективности адсорбции:
п-нитрофенол
< фенол < анилин < п-нитроанилин.
Различная адсорбция молекул ароматических
соединений может определяться рядом факторов, связанных с их химической
природой, среди которых величина постоянного дипольного момента, вероятность образования водородной связи ароматических молекул с
молекулами воды и ОН-группами гидроксилированной поверхности адсорбента,
способность к диссоциации соединений как слабых электролитов др.
Большое значение для адсорбции
ароматических соединений имеет межмолекулярная водородная связь, образующаяся
между функциональными группами поверхности адсорбента и ароматических веществ.
Наиболее эффективно в подобное межмолекулярное взаимодействие вступают группы
–ОН и –NH2.
Таблица 1 – Эффективность адсорбционного
извлечения ароматических соединений шлаком ПФНК, активированным 0,5 М раствором
H2SO4
|
Растворы концентрации 0,01 г/дм3 соединений |
Эффективность извлечения сорбатов,
% |
|
п-нитрофенол |
26,0 |
|
фенол |
32,7 |
|
анилин |
42,9 |
|
п-нитроанилин |
94,5 |
Определено уменьшение
концентрации анилина в растворе во времени при протекании адсорбции шлаком
(рис. 1). При этом эффективность и величина адсорбции а возрастают (таблица 2). При
начальном значении рН=6,7 практически отсутствует ионизация, как молекул
анилина, так и кислотных групп поверхности шлака. Рассчитана доля
неионизированных молекул (1-α) анилина (Кb =
3,82.10-10):
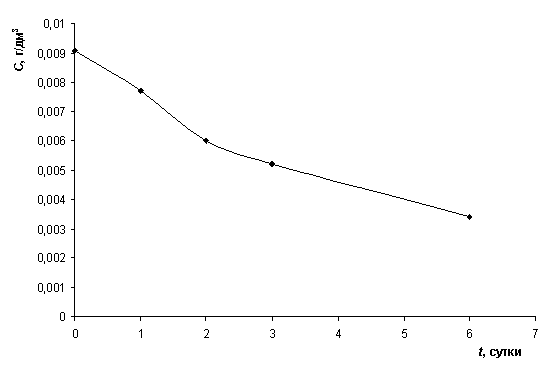
Рисунок 1 – Уменьшение концентрации
анилина в растворе при адсорбции шлаком ПФНК
(1-α) = 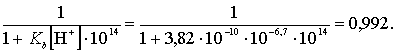
То есть 99,2 % молекул анилина пребывают в
неионизированной форме. Адсорбция неионизированных молекул анилина происходит в
результате протонирования молекулы и образования ионной пары по схеме:
≡ SiOH + C6H5NH2 ↔ ≡ SiO-[C6H5NH3]+
без вытеснения ионов водорода в раствор. Усиление адсорбции за счет дополнительного
взаимодействия поверхностных функциональных групп с неионизированными
молекулами слабых электролитов имеет важное практическое значение при глубокой
очистке вод. Подобный механизм адсорбции возможен и для п-нитроанилина. Таким образом, увеличение эффективности адсорбции
слабых ароматических электролитов на шлаковых частицах объясняется уменьшением
способности электролитов к диссоциации, а именно:
|
|
п-нитрофенол |
< |
фенол
|
< |
анилин |
< |
п-нитроанилин |
|
|
Ка
= 7,08 . 10-8 |
|
Ка = 1,3 . 10-10 |
|
Кb = 3,82 . 10-10 |
|
Кb = 1,05 .
10-13 |
|
(1-α) |
0,739 |
|
0,999 |
|
0,992 |
|
0,999 |
Отклонение в ряду по величинам констант
диссоциации Ка для
фенола и п-нитрофенола можно
объяснить более сильной диссоциацией п-нитрофенола
и образованием отрицательно заряженных частиц C6Н5О-,
Таблица 2 – Изменение
показателей адсорбции анилина шлаком ПФНК во времени (статический режим
адсорбции)
|
Время выдержки, сутки |
рН раствора в конце адсорбции |
Санилина, мг/дм3 |
а, мг/г |
Эффективность извлечения анилина, % |
|
начальные |
6,7 |
9,1 |
- |
- |
|
1 |
5,8 |
7,7 |
0,028 |
15,4 |
|
2 |
4,6 |
6,02 |
0,062 |
33,8 |
|
3 |
- |
5,2 |
0,078 |
42,9 |
|
6 |
6,4 |
3,4 |
0,114 |
62,6 |
электростатическая составляющая адсорбции которых уменьшается
при отталкивании от отрицательно заряженной поверхности.
Представляет интерес изучение влияния
кислотности раствора на адсорбцию слабых ароматических электролитов. Согласно
результатам таблицы 3 видно, что смещение рН как в кислую, так и в щелочную
область уменьшает адсорбцию п-нитроанилина.
Доля неионизированных молекул велика в каждом случае: 99,24 % (рН=3); 99,99 %
(рН=6,7); ![]() 100 % (рН=10). Отсюда следует, что степень ионизации п-нитроанилина как слабого электролита и
появление положительного заряда на его молекуле в кислых средах не определяет
величину адсорбции. В противоположном случае в кислой среде наблюдалось бы
увеличение адсорбции за счет электростатического взаимодействия молекул с
отрицательно заряженной поверхностью шлака. Торможение адсорбции п-нитроанилина, вероятно, вызвано
влиянием кислотности раствора на свойства поверхности шлака. В кислой области
подавляется диссоциация силанольных групп, и уменьшается отрицательный
потенциал поверхности. В щелочной области происходит разрушение гелеобразного
слоя силикатной кислоты, играющего немаловажную роль в протекании адсорбции.
100 % (рН=10). Отсюда следует, что степень ионизации п-нитроанилина как слабого электролита и
появление положительного заряда на его молекуле в кислых средах не определяет
величину адсорбции. В противоположном случае в кислой среде наблюдалось бы
увеличение адсорбции за счет электростатического взаимодействия молекул с
отрицательно заряженной поверхностью шлака. Торможение адсорбции п-нитроанилина, вероятно, вызвано
влиянием кислотности раствора на свойства поверхности шлака. В кислой области
подавляется диссоциация силанольных групп, и уменьшается отрицательный
потенциал поверхности. В щелочной области происходит разрушение гелеобразного
слоя силикатной кислоты, играющего немаловажную роль в протекании адсорбции.
Таблица 3 – Влияние кислотности раствора
на адсорбцию п-нитроанилина шлаком
ПФНК в статическом режиме в течение 3 суток
|
рН раствора |
Концентрация п-нитроанилина, мг/дм3 |
|
|
начальная |
конечная |
|
|
3,95 |
3,47 |
3,10 |
|
6,7 |
4,51 |
2,44 |
|
10,0 |
3,75 |
3,42 |