Медицина /7.
д.т.н., проф. Родионов И.В.1, к.т.н., доц.
Фомин А.А.1,
к.в.н., доц. Красников А.В.2
1Саратовский
государственный технический университет имени Гагарина Ю.А., Россия
2Саратовский
государственный аграрный университет имени Н.И. Вавилова, Россия
Статья
подготовлена при финансовой поддержке гранта РФФИ «а» № 13-03-00248
Микроструктурированные покрытия на основе биосовместимых оксидов
металлов и их влияние на приживляемость имплантационных конструкций в костной
ткани
Введение
В имплантационной хирургии опорно-двигательного аппарата и челюстно-лицевого отдела особое место занимают биосовместимые материалы в виде порошков, цельных и пористых блоков, гранул, а также пленки и покрытия на компактной металлической или полимерной основе. Однако при использовании металлических чрескостных и внутрикостных имплантационных конструкций требуются функциональные поверхностно-пористые покрытия, материалы которых при высоком уровне биосовместимости обладают повышенными механическими характеристиками. В связи с этим в настоящее время активно ведутся научно-исследовательские работы по созданию микро- и наноструктурированных биосовместимых материалов для медицинских покрытий. В частности, данные работы ведутся в следующих перспективных направлениях современной биоинженерии:
- создание микро- и наноструктурированных биокерамических покрытий на
медицинских хромоникелевых сталях и титановых сплавах для улучшения
приживляемости и срока службы имплантатов чрескостного и внутрикостного
назначения;
- создание на имплантатах металлокерамических поверхностных структур с
повышенной биоадгезивной способностью;
- формирование на ортопедических и стоматологических
имплантационных конструкциях покрытий из механических прочных и биоактивных материалов
для остеоинтеграции.
Получение керамики с развитой пористой структурой, обеспечивающей эффективное биомеханическое взаимодействие поверхности имплантатов с костной тканью, в сочетании с высокими прочностными свойствами открывает принципиально новые возможности в имплантологии. Решение проблемы, связанной с созданием прочных пористых покрытий для имплантатов, может заключаться в разработке и применении металлооксидной керамики на основе нетоксичных оксидов металлов, получаемых различными технологическими методами оксидирования [1-5]. Такие покрытия уже нашли применение при изготовлении протезов, некоторых медицинских имплантатов, например, тазобедренного и коленного суставов, характеризуемых высокими значениями коррозионной стойкости, твердости и износостойкости. Материалом основы могут являться титан, цирконий и их сплавы, а формируемые оксидные слои приобретают различную интерференционную окрашенность в зависимости от оксидного состава поверхности. Шероховатая оксидированная часть указанных типов имплантатов обеспечивает их улучшенное закрепление в костной ткани и позволяет повысить срок службы данных медико-технических изделий.
Формирование и структурообразование металлооксидных покрытий может осуществляться путем термического оксидирования исходно микрошероховатых поверхностей металлических имплантационных конструкций, при котором за счет термохимического реакционного взаимодействия металлической матрицы с кислородосодержащей газовой средой создаются биоинертные металлооксидные слои с высокой суммарной микропористостью, а в результате многократного осуществления термических газовых циклов «нагрев-охлаждение» имплантатов и вследствие растрескивания (фрагментации) частиц оксидов получается оксидная пленка с гетерогенной трещиноватой структурой, что существенно повышает ее остеокондуктивные качества и геометрическую биоактивность поверхности.
Целью работы являлось исследование микроструктуры поверхности оксидных покрытий, получаемых на стальных ортопедических имплантатах чрескостного назначения методом термического оксидирования на воздухе.
Методика и техника
экспериментальных исследований
Образцы
имплантатов в виде винтовых стержней для чрескостного остеосинтеза выполнялись
из биотолерантной нержавеющей стали 12Х18Н9Т (ГОСТ 5632-72) (рис. 1). Поверхность
имплантатов подвергалась пескоструйной обработке частицами корундового абразива
Al2O3 дисперсностью 250 мкм при давлении
воздушно-абразивной струи 0,67 МПа в течение 30 сек с целью создания исходной
микрошероховатости, обеспечивающей повышенную структурную неоднородность
формируемого оксидного покрытия. После предварительной пескоструйной обработки
стальные образцы проходили ультразвуковую очистку в спиртовом моющем растворе
при частоте УЗ-колебаний 22 кГц в течение 3 мин для удаления имеющихся жировых
загрязнений (пленок), ухудшающих взаимосвязь создаваемых металлооксидных слоев
с основой.

Рис. 1. Внешний
вид опытного стержневого имплантата
из нержавеющей стали
Воздушно-термическое оксидирование осуществлялось в экспериментальной
трубчатой электропечи сопротивления в виде кварцевой трубки диаметром 40 мм с
нихромовым спиральным нагревательным элементом и специальной асбестовой
теплоизоляцией. Значения напряжения на нихромовом нагревателе задавались с
помощью лабораторного автотрансформатора и соответствовали определенным
значениям температуры воздушной окислительной атмосферы в рабочей зоне печи.
Режим оксидирования предусматривал нагрев имплантатов в печи до температуры 250, 300, 350, 400 и 4500С с выдержкой
0,5, 1,0 и 1,5 ч при каждой температуре.
Морфология оксидных покрытий исследовались методом бесконтактного
определения размерных параметров выступающих частиц и имеющихся углублений,
включая поры. Для таких измерений и обработки их результатов использовались
анализатор изображений микроструктур АГПМ-6М с микроскопом и цифровой камерой Sony, а также специальная компьютерная
программа PlotCalc, объединенные в эффективный оптико-компьютерный
комплекс. При этом изображение
микрогеометрии исследуемой поверхности фиксировалось на дисплее с помощью
цифровой камеры, закрепленной на окуляре микроскопа, что позволяло изучать
характер распределения структурных элементов
поверхности, их форму и размеры, быстро анализировать несколько участков
поверхности и давать сравнительную оценку их микроструктурного состояния. Морфология
поверхности получаемых
покрытий также исследовалась методом растровой электронной микроскопии (РЭМ) с
применением аналитического оборудования типа MIRA II LMU, Tescan.
Результаты исследований и их анализ
Программная обработка
микроструктурных элементов термооксидированных стальных поверхностей позволила
получить необходимую статистическую информацию о характере морфологии покрытий,
ее основных размерных параметрах и характеристиках (рис. 2-6, табл.). Путем
оптико-компьютерного преобразования микроизображений поверхности из полихроматической
(цветной) гаммы в монохроматическую (черно-белую) был проведен анализ поверхностной
структуры покрытий с визуализацией имеющихся частиц оксидов (белые поля) и пор
(черные поля), а также плотности и равномерности их распределения по поверхности
(табл.). Установлено, что микроструктура покрытий имеет в различной степени
выраженную морфологию, где размер частиц и пор заметно отличается в зависимости
от режимов воздушно-термического оксидирования имплантатов (рис. 2-6, табл.).
Кроме этого, существенно изменяется плотность распределения структурных элементов
оксидированных поверхностей, что, в свою очередь, обусловливает варьирование
величины суммарной открытой пористости в пределах 31-56% (табл.).

Рис. 2. Микроструктура поверхности стальных
имплантатов, оксидированных на воздухе при t=2500С
и различной продолжительности τ

Рис. 3. Микроструктура поверхности стальных
имплантатов, оксидированных на воздухе при t=3000С
и различной продолжительности τ

Рис. 4. Микроструктура поверхности стальных
имплантатов, оксидированных на воздухе при t=3500С
и различной продолжительности τ
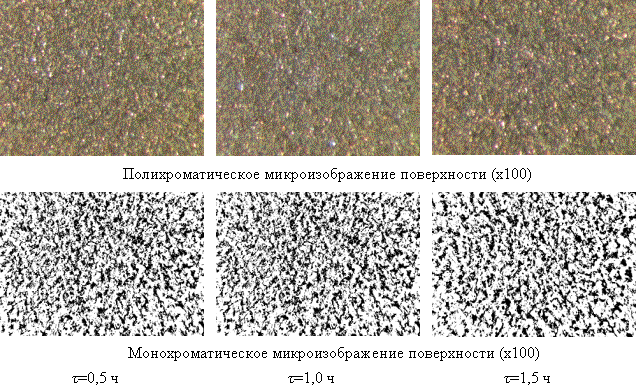
Рис. 5. Микроструктура поверхности стальных
имплантатов, оксидированных на воздухе при t=4000С
и различной продолжительности τ

Рис. 6. Микроструктура поверхности стальных имплантатов, оксидированных на воздухе при t=4500С и различной продолжительности τ
Таблица
Результаты программной обработки морфологических
характеристик оксидных покрытий, полученных на стальных имплантатах при
различных режимах (площадь исследуемой поверхности S=2,71 мм2)
|
Режимы оксидирования |
Характеристики
поверхности покрытий |
|||||||
|
Частицы |
Поры |
|||||||
|
t, °C |
τ, ч |
Кол-во, шт. |
Среднее значение,
мкм |
Дисперсия, мкм2 |
Кол-во, шт. |
Среднее значение,
мкм |
Дисперсия, мкм2 |
Суммарная
пористость, % |
|
250 |
0,5 |
678 |
35,73 |
95,47 |
740 |
30,47 |
81,93 |
48 |
|
1,0 |
545 |
35,47 |
100,1 |
840 |
30,48 |
83,97 |
45 |
|
|
1,5 |
572 |
31,70 |
101,3 |
834 |
31,95 |
77,20 |
41 |
|
|
300 |
0,5 |
505 |
21,35 |
87,1 |
865 |
37,06 |
72,81 |
41 |
|
1,0 |
448 |
21,31 |
92,0 |
811 |
40,51 |
83,32 |
39 |
|
|
1,5 |
360 |
19,88 |
99,76 |
1129 |
35,28 |
52,26 |
36 |
|
|
350 |
0,5 |
977 |
23,94 |
74,9 |
1170 |
29,9 |
58,8 |
45 |
|
1,0 |
448 |
21,31 |
92,0 |
811 |
40,51 |
83,32 |
31 |
|
|
1,5 |
342 |
19,94 |
102,16 |
1286 |
32,91 |
45,74 |
33 |
|
|
400 |
0,5 |
337 |
21,14 |
103,73 |
1390 |
32,55 |
42,11 |
33 |
|
1,0 |
575 |
5,94 |
20,41 |
1430 |
32,0 |
39,51 |
32 |
|
|
1,5 |
283 |
4,78 |
27,1 |
1173 |
33,85 |
46,67 |
31 |
|
|
450 |
0,5 |
393 |
5,66 |
23,38 |
931 |
37,87 |
70,05 |
39 |
|
1,0 |
- |
- |
- |
- |
- |
- |
- |
|
|
1,5 |
1008 |
9,85 |
14,31 |
319 |
24,27 |
107,79 |
56 |
|
Покрытия с полученной микроструктурой характеризуются повышенной морфологической гетерогенностью поверхности, которая необходима для эффективной остеоинтеграции имплантатов.
Были проведены эксперименты in vivo на лабораторных кроликах, которым в большеберцовые кости устанавливались оксидированные поверхностно-микропористые стержневые образцы. В течение 50 суток образцы функционировали в костях животных, после чего удалялись из организма и исследовались на предмет остеоинтеграционной способности поверхности по присутствию на ней костного регенерата.
Результаты исследований показали, что созданные микроструктурированные оксидные покрытия обладают высоким уровнем биологической совместимости и способностью интеграционного взаимодействия с костью (рис. 7).

Рис. 7. Внешний вид опытных
стержневых имплантатов с оксидными покрытиями после 50 суток функционирования в
костях лабораторных животных: а
– серия имплантатов; б –
увеличенная винтовая часть имплантата (на
поверхности имплантатов присутствует молодая костная ткань)
Таким образом, покрытия, полученные воздушно-термическим оксидированием чрескостных ортопедических конструкций из нержавеющей стали, могут быть рекомендованы к применению в клинической практике лечения переломов костей опорно-двигательного аппарата методом внешнего остеосинтеза.
Литература
1. Y.T. Sul, C.B. Johansson, S. Petronis et al.
Characteristics of the surface oxides on turned and electrochemically oxidized
pure titanium implants up to dielectric breakdown: the oxide thickness,
micropore configurations, surface roughness, crystal structure and chemical
composition // Biomaterials. Vol. 23, №. 2, 2002, pp. 491-501.
2. Патент РФ на изобретение
№2412723. Способ получения оксидного биосовместимого покрытия на чрескостных
имплантатах из нержавеющей стали / Родионов И.В., Бутовский К.Г. и др. Опубл.
27.02.2011.
3. Родионов
И.В. Применение технологии воздушно-термического оксидирования для получения оксидных
биосовместимых покрытий на чрескостных остеофиксаторах из нержавеющей стали // Перспективные материалы. №4,
2012. С. 36-43.
4. B. Feng, J.
Weng, B.C. Yang, S.X. Qu, X.D. Zhang. Characterization of surface oxide films
on titanium and adhesion of osteoblast // Biomaterials. Vol. 24, №25, 2003, pp.
4663-4670.
5. Rodionov I.V.
Steam-thermal oxide coatings for titanium medical implants // Biomedical
Engineering. 2012, Vol. 46, № 2. рр. 58-61.