Химия и химические технологии / 6. Органическая химия
К.х.н.
Карпинец А.П., Федорченко Д.Г.
Донецкий
национальный технический университет, Украина
КИНЕТИЧЕСКИЕ И ТЕРМОДИНАМИЧЕСКИЕ ХАРАКТЕРИСТИКИ РЕАКЦИИ ПОЛУАЦЕТАЛИЗАЦИИ, ПРОТЕКАЮЩЕЙ В
МЕТАНОЛ-БЕНЗОЛЬНЫХ РАСТВОРАХ
В наших предыдущих работах [1,2] выявлена
специфика межчастичных взаимодействий
компонентов систем: карбонильное соединение − бинарный растворитель
(метанол-бензол, метанол-диоксан) и существенно расширен диапазон полярографирования
органических веществ до ε 6.4.
Цель данной работы
– на примере пространственно-затрудненных ароматических кетонов: ацетофенона,
2-ацетилнафталина, 2-ацетилантрацена, бензофенона, а также 9-флуоренона и
9,10-антрахинона изучить влияние стерического фактора на кинетические и
термодинамические характеристики реакции образования полуацеталей.
Кинетику реакции полуацетализации изучали
полярографическим методом. Полярограммы регистрировали на приборе ПУ-1 через
каждые 3с в течение 40 мин. Аппаратура, методика экспериментов и расчетов
детально описаны в работах [1,2]. Мольная доля метанола (m) в бинарном растворителе варьировалась в интервале
0,353-1,0; диэлектрическая проницаемость (ε) системы находилась в
диапазоне 6,4-32,6; динамическая вязкость среды (η) изменялась в пределах
0,547-0,591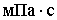 .
.
При сопоставлении данных, представленных в
таблицах 1,2, нетрудно заметить, что в системе растворителей одинакового
состава константы скорости и равновесия процесса полуацетализации уменьшаются
по мере увеличения размера заместителя в молекуле кетона.
Влияние пространственного фактора
подтверждается и термодинамическими характеристиками процесса (таблица 3). (Здесь:
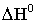 − изменение эн-
− изменение эн-
тальпии реакции, кДж/моль; 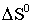 − изменение ее
энтропии,
− изменение ее
энтропии, 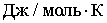 ). Для всех изученных веществ наблюдаются довольно заметные
изменения энтропии; при этом своего максимального значения они достигают у
2-ацетилантрацена.
). Для всех изученных веществ наблюдаются довольно заметные
изменения энтропии; при этом своего максимального значения они достигают у
2-ацетилантрацена.
Из сравнения результатов, приведенных в
таблицах 1-3, выявляется вполне определенная зависимость величин 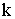 ,
, 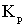 ,
, 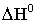 и
и 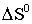 от состава раствора. Медленее
всего процесс протекает в метаноле, находящемся преимущественно. в ассоциированном
состоянии [3]. Накопление ассоциатов в системе, во-первых, уменьшает
концентрацию мономерных молекул спирта (реагента химической реакции), а,
во-вторых, затрудняет достаточное сближение и необходимую ориентацию
гидроксильной и карбонильной групп [4]. В этой среде обнаружено и наибольшее
изменение энтропийного фактора.
от состава раствора. Медленее
всего процесс протекает в метаноле, находящемся преимущественно. в ассоциированном
состоянии [3]. Накопление ассоциатов в системе, во-первых, уменьшает
концентрацию мономерных молекул спирта (реагента химической реакции), а,
во-вторых, затрудняет достаточное сближение и необходимую ориентацию
гидроксильной и карбонильной групп [4]. В этой среде обнаружено и наибольшее
изменение энтропийного фактора.
При переходе от метанола к его смесям с
бензолом прослеживается закономерный характер изменения кинетических констант
кетонов, обусловленный, как и в случае альдегидов [2], возрастанием вязкости
системы, снижением ее диэлектрической проницаемости, а также межмолекулярным
взаимодействием компонентов бинарного растворителя. Последний эффект оказывает
доминирующее влияние на ход изменения энтропии.
Существенно отметить, что максимальное
изменение энтропии имеет место для системы с содержанием спирта 0,7 мол. долей,
для которой, по данным физико-химического анализа [2,5], характерны и
наибольшие отклонения значений мольного объема, плотности и вязкости от
аддитивных.
Представляло интерес оценить влияние
состава среды и на процесс электрохимического восстановления исследуемых
карбонильных соединений. Измеренные нами значения потенциалов полуволн (относительно
насыщенного каломельного электрода) указаны в таблице 4.
Из данных таблицы 4 следует, что легче
всего восстановление деполяризатора осуществляется в системе, содержащей 0,895
мол. долей метанола. В этих условиях, несмотря на некоторое уменьшение
диэлектрической проницаемости среды, усиливается и диссоциация фонового
электролита.
Таблица 4
Потенциалы полуволн полярографического восстановления
кетонов и хинонов в метанол-бензольных буферных растворах
|
Соединение
|
m 1.000
|
0.895
|
0.700
|
0.497
|
0.353
|
|
ε 32.6
|
26.3
|
16.3
|
9.2
|
6.4
|
|
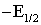 , В , В
|
|
Ацетофенон
|
1.820
|
1.440
|
1.681
|
1.741
|
2.090
|
|
2-Ацетилнафталин
|
1.681
|
1.341
|
1.630
|
1.680
|
1.951
|
|
2-Ацетилантрацен
|
1.530
|
1.221
|
1.560
|
1.601
|
1.870
|
|
Бензофенон
|
1.762
|
1.341
|
1.641
|
1.681
|
2.020
|
|
9-Флуоренон
|
1.270
|
0.941
|
0.981
|
1.452
|
1.540
|
|
9,10-Антрахинон
|
0.672
|
0.452
|
0.802
|
0.910
|
0.981
|
Увеличение количества бензола
в бинарном растворителе вызывает смещение потенциалов в более отрицательную
область. Естественно полагать, что такой сдвиг обусловлен суммарным действием
нескольких факторов: изменением межфазового потенциала, уменьшением
диэлектрической проницаемости, образованием ассоциатов, конкурирующим с
сольватацией молекул деполяризатора.
Симбатно деполяризатору к
более отрицательным значениям смещаются и потенциалы разряда индифферентного электролита.
Объяснением этого эффекта является то, что равновесие сольватированных ионов
лития и ионных пар (ион лития-противоион) по мере понижения ε сдвигается в
сторону последних.
Литература:
1.
Карпинец А. П.,
Федорченко Д. Г. Кинетика электровосстановления карбонильных соединений в
системах метанол-бензол и метанол-диоксан.// Materialy IX Międzynarodowej naukowi-praktycznej konferencij «Strategiczne pytania
światowej nauki -
2013» V .25. Nauk biologicznych. Chemia i chemiczne technologie.: Przemyśl. Nauka i studia, 2013. – Р. 66 – 70.
2.
Карпинец А. П. Специфика
электровосстановления карбонильных соединений в метанол-бензольных и
метанол-диоксановых ратворах.// Журнал прикладной химии. – 1999 – Т. 72. - № 6.
– С. 954 – 957.
3.
Райхардт К. Растворители
и эффекты среды в органической химии. М.: Мир, 1991. – 763 с.
4.
Яновская Л. А., Юфит С.
С., Кучеров В. Ф. Химия ацеталей. М.: Наука, 1975.−275с.
5.
Никифоров М. Ю., Альпер
Г. А., Дуров В. А. Растворы неэлектролитов в жидкостях. − М.: Наука,
1989.−263с.
![]() .
.![]() − изменение эн-
− изменение эн-