Екологія/6. Екологічний моніторинг
Батіщева Г.С., к.б.н.
Поліщук О.В., к.т.н. Котинський А.В.
Національний
університет харчових технологій, Україна
Інститут
ботаніки ім. М.Г. Холодного НАН України, Україна
Вплив
фенольних сполук на фотосинтетичний апарат мікроводоростей Chlorella vulgaris і Chlamydomonas reinhardtii
Фенольні сполуки являють собою похідні
ароматичних сполук, що містять одну або декілька гідроксильних груп, з’єднаних
з атомами вуглецю ароматичного ядра. Потрапляють у водойми безпосередньо з промисловими
стічними водами, в результаті вторинного забруднення, крім того можуть бути
продуктами життєдіяльності гідробіонтів (біогенні феноли) [2]. Фенольні сполуки,
в кількості, що перевищує гранично допустиму концентрацію у воді (ГДКфенол=0,001
мг/л [3]), токсичні для гідробіонтів і порушують процес самоочищення водойми.
Для визначення вмісту фенольних сполук у
водоймі використовують екстракційно-фотометричні методи, які дозволяють
визначити сумарну масову концентрацію фенольних сполук в пробі – «фенольний
індекс» [1]. Також наявність та токсичність фенольних сполук можна досліджувати
за реакцією фотосинтетичного апарату мікроводоростей, використовуючи метод
індукції флуоресценції хлорофілу а.
Для роботи використовували культури Chlorella vulgaris та Chlamydomonas reinhardtii. Культуру водорості C. vulgaris штам AsLi1 (Інститут
ботаніки НАН України) культивували на середовищі Тамія протягом 7 діб за умов
цілодобового освітлення інтенсивністю 3 кЛк, при температурі 28-30°С з
подальшим переведенням в турбідостатний режим. Адаптація до умов турбідостату
тривала 3 доби. Культуру водорості Chlamydomonas reinhardtii штам CC-127 (Інститут
ботаніки НАН України) культивували на середовищі ТАР
при температурі 24-25°С за умов цілодобового освітлення інтенсивністю 2,2-2,3
кЛк.
Дослідження проводили з використанням
наступних фенольних сполук: ортонітрофенолу (0,005 – 0,05%), паранітрофенолу (0,001
– 0,032%), пірокатехіну (0,05 – 1%), фенолу (0,05 – 0,4%) та галової кислоти (0,01
– 0,3%).
Оцінювання дії фенольних сполук проводили
методом індукції флуоресценції хлорофілу а
на флуорометрі XE-PAM
(Walz, Німеччина) за наступними показниками: максимальний
потенційний квантовий вихід змінної флуоресценції хлорофілу (Fv/Fm);
фотохімічне гасіння флуоресценції хлорофілу (qP); ефективний квантовий вихід
фотосистеми ІІ (ФPSII).
Фенольні сполуки в різних концентраціях інгібують
фотосинтез досліджених мікроводоростей, а їх дія має об’єкт-залежну специфіку. Концентрації
фенольних сполук, при яких відбувається зниження показника ФPSII на
50%, представлені в таблиці 1.
Таблиця
1
Концентрації
фенольних сполук, при яких спостерігається 50 %-ве зниження показника ФPSII
|
Сполука |
Діапазон концентрацій, % |
Chlorella
vulgaris |
Chlamydomonas reinhardtii |
|
Паранітрофенол, % |
0,001-0,032 |
0,008 |
---- |
|
Ортонітрофенол, % |
0,005-0,05 |
0,017 |
0,016 |
|
Фенол, % |
0,05-0,4 |
0,185 |
0,079 |
|
Пірокатехін, % |
0,05-1 |
0,200 |
0,079 |
|
Галова кислота, % |
0,01-0,3 |
0,080 |
0,281 |
На рисунку 1 представлені дані щодо впливу
паранітрофенолу і ортонітрофенолу на ефективний квантовий вихід фотосистеми ІІ
(ФPSII) мікроводорості C. vulgaris і Ch. reinhardtii. Паранітрофенол
в максимальній концентрації 0,032% пригнічує фотосинтез C. vulgaris на 60%, але в межах обраних
концентрацій не чинить вираженого впливу на Ch. reinhardtii.
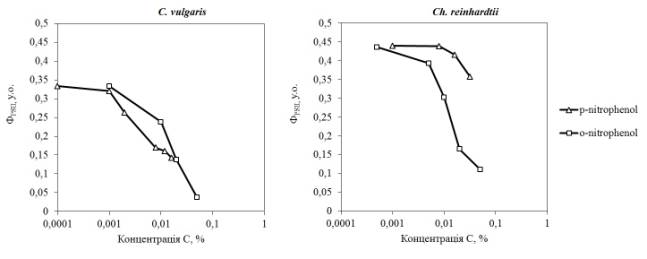
Рисунок 1. Вплив паранітрофенолу і ортонітрофенолу на
ефективний квантовий вихід фотосистеми ІІ (ФPSII) мікроводоростей C. vulgaris та
Ch. reinhardtii
На рисунку 2 представлені дані щодо впливу
фенолу, пірокатехіну і галової кислоти на показник ФPSII у C. vulgaris і Ch. reinhardtii.
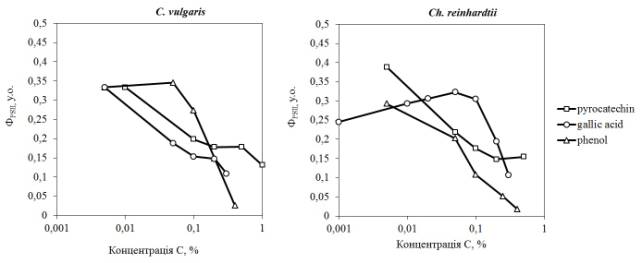
Рисунок 2. Вплив фенолу, пірокатехіну і галової кислоти на
ефективний квантовий вихід фотосистеми ІІ (ФPSII) мікроводоростей C. vulgaris та
Ch. reinhardtii
Фенол в концентрації 0,05% пригнічує фотосинтез
Ch. reinhardtii на 30%, однак не
впливає на фотосинтез у C. vulgaris, його дія стає значною
лише при вищих концентраціях. Галова
кислота інгібує фотосинтез C. vulgaris починаючи з низьких
концентрацій, в той час як у Ch. reinhardtii спостерігається стимуляція
фотосинтезу на 20% при концентраціях галової кислоти до 0,05%, і лише при вищих
концентраціях спостерігається різкий спад активності. Пірокатехін інгібує фотосинтез
досліджених мікроводоростей в однакових концентраціях.
Досліджені фенольні сполуки пригнічують
функціонування фотосинтетичного апарату мікроводоростей C. vulgaris та Ch. reinhardtii, знижуючи
ефективний квантовий вихід фотосистеми ІІ (ФPSII). Різна специфіка
чутливості С. vulgaris та Ch. reinhardtii до фенольних сполук дозволяє
рекомендувати використання методу індукції флуоресценції хлорофілу досліджених мікроводоростей
для подальшого використання при розробці експрес-методу виявлення досліджених речовин
у водоймах, в які здійснюється скидання стічних вод, які містять фенольні
сполуки.
Література:
1. Воробьева Т.В., Терлецкая А.В., Кущевская Н.Ф. Стандартные и
унифицированные методы определения фенолов в природных и питьевых водах и
основные направления их совершенствования // Химия и технология воды. – 2007. –
29, №4. – С. 370-390.
2. Кондратьева JI.M. Вторичное загрязнение водных экосистем // Водные ресурсы.
– 2000. – 27, № 2. – С. 221-231.
3. Тарасова В.В., Малиновский А.С., Рибак М.Ф. Екологічна стандартизація і
нормування антропогенного навантаження на природне середовище/Навчальний
посібник. – К: Центр учбової літератури – 2007. – 200с.