Бойко І.О.,студент, Жерносєкова І. В., к.б.н.,Черевач
Н. В., к.б.н.,
доцент
Дніпродзержинський державний технічний
університет
Дніпропетровський національний університет
ім.О. Гончара
ДОСЛІДЖЕННЯ КОНВЕРСІЇ КРОХМАЛЮ АМІЛОЛІТИЧНИМИ ФЕРМЕНТАМИ
СТРЕПТОМІЦЕТУ
В останні роки розширюються
можливості використання мікроорганізмів як біотехнологічних джерел промислово важливих ферментів.
Крохмальдеградуючі ферменти, зокрема амілази, привертають увагу дослідників завдяки їх технологічній
важливості й економічній вигідності. Вони характеризуються широким спектром
застосування в різних галузях і становлять близько 30% світової
продукції ферментів [1]. Особливості технологічних процесів у багатьох промислових
виробництвах, де використовують амілази, потребують використання ферментних
препаратів, які були б стійкими до підвищених температур і здатними
гідролізувати сировину при високих температурах..
Виходячи з вищесказаного, особливо актуальним є дослідження процесу
біосинтезу термостабільних
амілолітичних ферментів штамами бактерій – продуцентів біологічно-активних
речовин.
Метою роботи було вивчення
накопичення амілолітичних ферментів штамом бактерій Streptomyces recifensis var. lyticus 2Р-15 при вирощуванні в
глибинних умовах.
В ході виконання роботи було
досліджено динаміку синтезу амілолітичних ферментів при вирощуванні штаму Streptomyces recifensis var. lyticus 2Р-15 в глибинних умовах; вивчено спрямований синтез амілолітичних ферментів при
індукції шляхом внесення у ферментаційне середовище різних концентрацій крохмалю;
підібрано умови культивування штаму мікроорганізму для отримання
максимального виходу ферменту; досліджено рівень накопичення біомаси штамом
стрептоміцету при додаванні у середовище різних концентрацій крохмалю.
В
процесі культивування на ферментаційному середовищі продуцент накопичує
комплекс ферментів у культуральній рідині. Тому амілолітичну активність
визначали безпосередньо у культуральній рідині після звільнення ії від міцелію
за методом Асатіані [2].
Амілолітичну
активність розраховували за формулою :
![]()
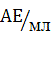 =
= ![]() , де
, де
Дк
-різниця оптичної густини контрольного та дослідного зразків;
60
-кількість крохмалю у реакційній суміші, мг;
Р –
розведення зразка;
10
-кількість крохмалю, для гідролізу якого потрібна одна одиниця ферментативної
активності, мг.
Визначення біомаси
проводили ваговим методом і виражали в г/л [7].
Відомо, що одним із способів посилення
активності біосинтезу та накопичення ферментів є внесення індуктора у
ферментаційне середовище. У якості індуктора , як правило, використовується
субстрат. Виходячи із вищесказаного, для збільшення
синтезу амілолітичних ферментів, нами
було проведено індукцію шляхом внесення різних концентрацій крохмалю у
ферментаційне середовище. Результати дослідження показали, що у
ферментаційному середовищі з 1% крохмалю, максимальна амілолітична активність
зареєстрована на 48 годину культивування і
складала 4,7 АЕ/мл, на 96 годину
залишалась приблизно на тому ж рівні –
4,6 АЕ/мл. Тобто подальшого збільшення активності ферменту не відбувалося
(рисунок 1). Максимальна амілолітична активність на 48 годину культивування на
ферментаційному середовищі з 2 та 4% крохмалю складала 5,9 та 4,3 АЕ/мл, а на 96 годину – 0,55 та 4,9 АЕ/мл, відповідно. Таким чином,
активність ферментів при 2% крохмалю після другої доби знизилася на порядок, а
при 4% - незначно зросла та стабілізувалась.
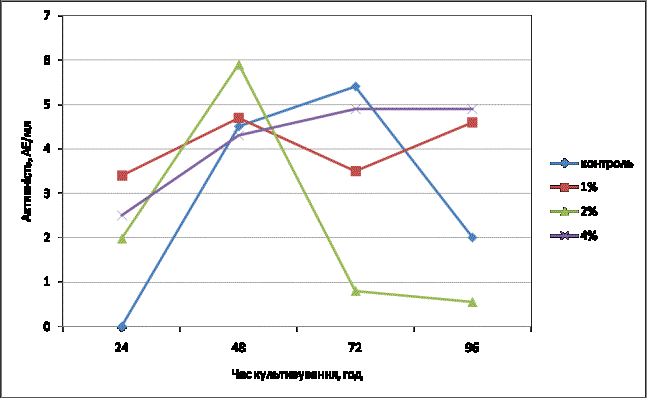
Рисунок 1– Активність амілаз з різною концентрацією
крохмалю
Як
видно з отриманих даних, амілолітична активність залежить від концентрації
крохмалю в середовищі та від тривалості культивування.
Аналіз
динаміки накопичення амілаз у культуральному середовищі з різною концентрацією
крохмалю показує, що найвищого значення
амілолітична активність на першу добу досягає на середовищі з 1% крохмалю. На другу добу
культивування значне збільшення
амілолітичної активності зареєстровано
у всіх варіантах досліду, проте максимальне ії значення виявлено у
середовищі, з 2% крохмалю, де активність склала 5,9 АЕ/мл, що перевищує
інші максимальні значення на цю добу в 1,3 рази. На третю добу культивування
штаму амілолітична активність значно
знизилась у варіантах досліду з 1 та 2 % субстрату. Звертає на себе увагу
те, що у варіанті з 4% активність підвищилась та склала 4,9 АЕ/мл. На цей час
припадає і максимальне значення
активності контрольної проби (5,4
АЕ/мл). На четверту добу відмічається стабілізація активності амілаз при 1% та
4% субстрату та подальше її падіння при
2% і у контрольному варіанті.
При
дослідженні динаміки накопичення біомаси штамом 2Р-15 в умовах додавання
субстрату в різних
концентраціях спостерігали, що на першу добу культивування приріст біомаси перевищував
на 38 та 206% рівень
контролю при використанні
посівного середовища з 2 і 4% крохмалю. Динаміка накопичення біомаси у
середовищі з 1% крохмалю незначно відрізнялася від динаміки накопичення у
контрольному середовищі.
Через
дві доби культивування біомаса досягла максимального значення 259% до контролю
при використанні ферментаційного середовища з 4% крохмалю. На середовищі з 2%
крохмалю накопичення біомаси перевищило значення контролю на 15%. На третю добу
культивування на середовищі з 1% крохмалю відмічалося незначне підвищення біомаси – на 8%; а з 4% субстрату
досягало максимального значення, яке
на 116% перевищувало контроль. При використанні середовища з 2% крохмалю накопичення
біомаси не відбувалося. На 96 годину культивування на середовищі з 1% крохмалю
накопичення біомаси також не відбувалося, а на середовищі з 4% крохмалю кількість
біомаси зростала до 185% порівняно з контролем.
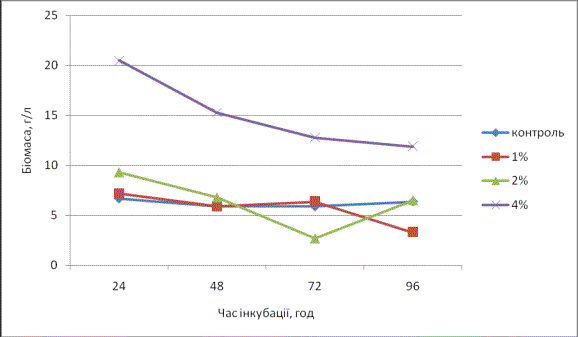
Рис.2 –
Накопичення біомаси штамом 2Р-15
на середовищах з різною концентрацією крохмалю
Як
відомо, підвищення рівня накопичення біомаси відбувалося за рахунок збагачення
поживного середовища та більш ефективного використання його субстратів [3-6].
Отримані в результаті дослідження штаму 2Р-15 дані показують, що на всіх
поживних середовищах максимальне накопичення біомаси відбувалося на першу добу,
найбільшого рівня досягало на середовищі з 4% крохмалю і становило – 20,5 г/л.
Таким чином, максимальне
накопичення біомаси відбувалося на першу добу розвитку культури та поступово
знижувалося до четвертої доби, а синтез вторинних метаболітів (амілаз) мав
протилежну тенденцію – поступово зростав до другої та третьої доби
культивування, що співпадало з відомими літературними джерелами. В результаті проведених
дослідів встановлено, що: максимальне значення активності амілаз припадало
на третю добу; з підвищенням вмісту
крохмалю в середовищі підвищувалася доля амілаз та їх активність; не доцільно
вносити 4% індуктора в середовище, оскільки при цьому рівень активності
ферментів була нижчою, ніж при 2%, процес їх синтезу затримувався; максимальне
накопичення біомаси продуценту амілаз відбувалося при вирощувані на середовищі
з 4% крохмалю; максимальний вихід амілолітичних ферментів спостерігався на
другу добу культивування при додаванні 2 % крохмалю у якості індуктора у
ферментаційне середовище.
Поживні середовища з 2% крохмалю можна рекомендувати
для використання у біотехнологічних виробництвах, що призведе до скорочення
циклу ферментації і забезпечить максимальний економічний ефект.
ЛІТЕРАТУРА:
- Sivaramarkrishtan
S., Gangadharan D., Kesavan Madhavan
Nampoothiri et al. α-Amylases from microbial
sources an overview on recent developoments // Food Technol.
Biothechnol. — 2006. — V. 44, N 2. — P. 173–184.
2.
Асатиани В.С. Ферментные методы анализа.
Москва; Наука, 1989, с.528.
- Бабицкая В.Г. Исследование амилолитической активности
актиномицетов. Автореф. канд. дисс. – Минск, 1998. -С.58.
4.
Андріюк К.І. Синтез біологічно-активних речовин
ґрунтовими актиноміцетами //Мікробіол. ж. – 1988. – ЗО, №5 – 398с.
5. Фениксова
Р.В. и Тихомирова А.С. Среда для накопления амилазы и
протеиназы
в глубинной культуре В. subtilis
// Микробиология. – 1989.
–
29.
– №6.
– 894с.
- Бабенко Ю.
С., Килочек Т.П. Оптимизация питательной среды и направленный биосинтез литических ферментов //
Всесоюзная конференция «Управляемое культивирование микроорганизмов» /Тез.докл. – Пушино,1986. – С.77.