Химия и химическая технология/7. Неорганическая химия
Д.х.н. Скворцов В.Г.*, к.х.н. Кольцова О.В.*,
к.х.н. Пыльчикова Ю.Ю.*,
к.х.н. Ершов М.А.**, Леонтьева А.Ю.*
*Чувашский государственный педагогический университет
им. И.Я.Яковлева
(ЧГПУ им. И.Я.Яковлева), Россия
**Чувашская государственная сельскохозяйственная
академия (ЧГСХА),
Россия
ТРОЙНАЯ СИСТЕМА
СУЛЬФАТ МЕДИ – МАЛОНДИАМИД – ВОДА ПРИ
25°С
Микроэлементы
играют незаменимую роль в жизнедеятельности, как растений, так животных и
человека [1]. При их недостатке невозможны нормальные рост и развитие живых
организмов, поскольку замедляются ферментативные реакции, что приводит к
нарушению обмена веществ, уменьшению интенсивности дыхания, биосинтеза и т.п.
Одним из важных микроэлементов является медь.
Азот, входящий в состав аминов, амидов,
аминокислот, белков, является основным
питательным элементом всего живого [2].
С
целью изучения комплексообразования, а также получения новых биологически
активных веществ, методами физико-химического анализа изучена тройная система
сульфат меди – малондиамид (МДА) – вода при 25°С. Исследование проводили методами
изотермической растворимости, денси-, рефракто- и рН-метрии [3].
Для
опытов брали предварительно очищенные пентагидрат сульфата меди CuSO4·5H2O марки «ч.д.а.»
и диамид малоновой кислоты CH2(CONH2)2 той же квалификации.
Изотермическую
среду создавали в водном термостате 1ТЖ-0-03 с точностью ±0,1°С. Равновесие в системе при постоянном энергичном перемешивании
устанавливалось через 24 ч. Взятие проб жидких и твердых фаз производили,
фильтруя насыщенные равновесные растворы через стеклянный фильтр Шотта средней
пористости. Плотность растворов измеряли пикнометрически, показатель преломления
– на рефрактометре РФ-454БМ, рН – на иономере «Мультитест» с ионоселективными
электродами.
Анализ жидких и твердых фаз вели на ион меди (II) иодометрически, азот амида
определяли щелочным гидролизом и параллельно методом Кьельдаля. Составы
кристаллизующихся твердых фаз устанавливали по Скрейнемакерсу.
Экспериментальные данные по
растворимости и свойствам жидких фаз системы СuSO4 – CH2(CONH2)2 – Н2О при
25°С представлены
в таблице 1 и на рис. 1-2.
Как
видно из рис.1, диаграмма растворимости системы СuSO4 – CH2(CONH2)2 – Н2О
состоит из четырех ветвей. Первая, небольшая ветвь, соответствует
кристаллизации исходного пентагидрата сульфата меди. Растворимость медной соли
при 25°С составляет 16,53 мас.%.
По мере добавления малондиамида она повышается до 18,78 мас.% в эвтонической
точке. Далее две большие ветви свидетельствуют об образовании двух комплексов.
Прямолинейные лучи, соединяющие фигуративные точки жидких фаз и твердых остатков,
при закономерном продолжении сходятся в точках образования новых соединений,
химический состав которых: 50,63 мас.% СuSO4, 32,28
мас.% CH2(CONH2)2,
17,09 мас.% Н2О и 43,96 мас.% СuSO4, 56,04
мас.% CH2(CONH2)2.
Это соответствует молекулярным формулам: СuSO4×CH2(CONH2)2×3Н2О и СuSO4×2CH2(CONH2)2. Четвертая ветвь ограничивает поле
кристаллизации МДА. Сульфат меди оказывает на амид незначительное высаливающее
действие.
Соединение,
отвечающее составу СuSO4×CH2(CONH2)2×3Н2О, представляет собой синие кристаллы,
растворимые в воде инконгруэнтно.
Найдено,
мас.%: Cu – 19,86; N – 8,58.
Для СuSO4×CH2(CONH2)2×3Н2О вычислено, мас.%: Cu – 20,25; N – 8,86.
Его
плотность – 1,798 г/см3, молекулярный объем – 165,53 см3/моль,
удельный объем – 0,71 см3/г.
У
конгруэнтно растворимого безводного соединения СuSO4×2CH2(CONH2)2 кристаллы также синего цвета:
Найдено, мас.%: Cu – 17,63; N –
15,41.
Для
СuSO4×2CH2(CONH2)2 вычислено, мас.%: Cu – 17,58; N –
15,38.
Плотность синтезированного
соединения, измеренная в бензоле, равна 1,944 г/см3, молекулярный
объем – 187,06 см3/моль, удельный объем – 0,51 см3/г.
Параллельно с растворимостью определяли
плотность (d), показатель преломления (n), рН, сумму молей солей на 1000 молей воды (S) насыщенных равновесных растворов и строили их
изотермы. Они изменяются в соответствии с характером диаграммы растворимости,
подтверждая ее вид. Каждой фазе, возникающей в системе, соответствует своя
ветвь на изотермах свойств.
В целях идентификации полученных комплексов изучены
их рентгенометрические характеристики.
Данные рентгенофазового анализа показывают, что новые соединения по положению и
интенсивности пиков резко отличаются от таковых исходных веществ. Соединения
имеют собственный набор межплоскостных расстояний. Рентгенофазовый анализ
образцов проводили на дифрактометре ДРОН – 3,0 (Cu Kα– излучение).
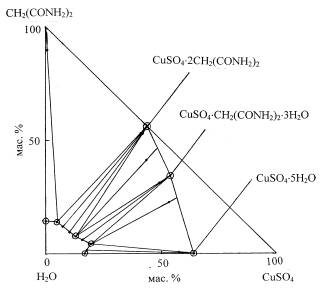
Рис. 1. Диаграмма растворимости системы
СuSO4 – CH2(CONH2)2 – Н2О при 25°С
Таблица 1. Растворимость и свойства жидких
фаз системы
СuSO4 – CH2(CONH2)2 – Н2О
при 25°С
|
№ точки |
Жидкая фаза, мас.% |
S |
n |
d |
pH |
Твердый остаток, мас.% |
Твердая фаза |
||
|
СuSO4 |
МДА |
СuSO4 |
МДА |
||||||
|
1 |
16,53 |
– |
22,33 |
1,367 |
1,162 |
3,33 |
63,94 |
– |
СuSO4×5Н2О |
|
2 |
17,44 |
1,97 |
28,72 |
1,373 |
1,175 |
3,30 |
60,12 |
0,23 |
То же |
|
3 |
18,78 |
4,65 |
38,38 |
1,380 |
1,191 |
3,25 |
59,61 |
0,45 |
-«- |
|
4 |
18,79 |
4,66 |
38,42 |
1,380 |
1,192 |
3,25 |
53,37 |
22,52 |
СuSO4×5Н2О + СuSO4×СH2(CONH2)2×3Н2О |
|
5 |
18,79 |
4,67 |
38,45 |
1,380 |
1,192 |
3,25 |
50,63 |
32,28 |
СuSO4×СH2(CONH2)2×3Н2О |
|
6 |
15,53 |
6,18 |
36,31 |
1,375 |
1,156 |
3,50 |
52,00 |
33,05 |
То же |
|
7 |
12,49 |
7,58 |
34,35 |
1,371 |
1,125 |
3,75 |
52,11 |
33,68 |
-«- |
|
8 |
12,50 |
7,59 |
34,47 |
1,371 |
1,125 |
3,75 |
43,30 |
41,37 |
СuSO4×СH2(CONH2)2×3Н2О + СuSO4×2СH2(CONH2)2 |
|
9 |
12,50 |
7,60 |
34,42 |
1,371 |
1,126 |
3,75 |
43,96 |
56,04 |
СuSO4×2СH2(CONH2)2 |
|
10 |
10,44 |
9,58 |
35,85 |
1,369 |
1,095 |
3,90 |
44,00 |
56,00 |
То же |
|
11 |
7,00 |
12,75 |
37,87 |
1,366 |
1,076 |
4,20 |
43,10 |
54,60 |
-«- |
|
12 |
4,76 |
14,55 |
38,46 |
1,364 |
1,075 |
4,40 |
42,98 |
55,03 |
-«- |
|
13 |
4,77 |
14,56 |
38,52 |
1,364 |
1,075 |
4,43 |
0,86 |
88,27 |
СH2(CONH2)2 |
|
14 |
– |
14,72 |
30,46 |
1,356 |
1,037 |
5,80 |
– |
100,00 |
То же |
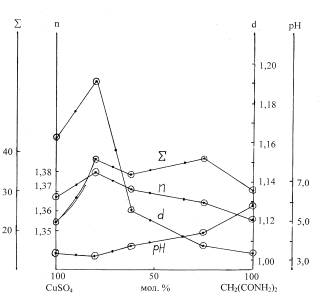
Рис. 2.
Свойства насыщенных растворов системы СuSO4 – СH2(CONH2)2
– Н2О при 25˚С
Таким образом, установлено, что при
взаимодействии сульфата меди (II) с диамидом
малоновой кислоты, образуются два новых комплексных соединения СuSO4·CH2(CONH2)2×3Н2О и
СuSO4·2CH2(CONH2)2.
Индивидуальность их подтверждена химическим, пикнометрическим, а также рентгенофазовым
анализами.
Литература:
1. Школьник М. Я. Микроэлементы
в жизни растений. – Л.: Наука, 1974. – 324с.
2. Радцева Г. Е., Радцев В. С.Физиологические
аспекты действия химических регуляторов роста на растения. – М.: Наука, 1982. –
147 с.
3. Аносов В. Я., Озерова М. И.,
Фиалков Ю. Я. Основы физико-химического анализа – М.: Наука, 1978. – 504
с.