УДК 664.2 (075.8)
ГІДРОЛІЗ
КУКУРУДЗЯНОГО КРОХМАЛЮ В ПРИСУТНОСТІ У ЯКОСТІ КАТАЛІЗАТОРА СУЛЬФАТНОЇ І
ХЛОРИДНОЇ КИСЛОТ
Дмитрієнко Г. В., Нагорна С. Ю., Нагорний Ю. С.
Дніпродзержинський
державний технічний університет,
вул.
Дніпробудівська 2, м. Дніпродзержинськ
Україна,
51918
Об’єкт досліджень – порівняння ефективності використання
сульфатної і хлоридної кислот у якості каталізатора гідролізу крохмалю.
Гідроліз протікає при термічній, хімічній або ферментативній взаємодії на
молекулу крохмалю. В залежності від зовнішніх умов процесу (тривалості,
температури, концентрації крохмалю і т.ін.) досягається різноманітна глибина
гідролізу, яка і визначає якість кінцевого продукту.
Дослідження проводилися в
лабораторних умовах на установці, яка відтворювала реальний процес гідролізу
крохмалю у присутності в якості каталізатора сульфатної і хлоридної кислот.
Установка (див. рисунок 1) складалася з термостійкого скляного реактора -
гідролізера – 2, електричної печі – 1 для підтримки температури в реакторі в межах
80 – 110 оС, термометру – 4 для контролю заданої температури процесу та
насосу – 9 для створення тиску в гідролізері.
Порядок проведення експерименту складався з декількох
етапів.
На першому етапі проводилося приготування
крохмального молока та визначення його концентрації денсиметричним
методом.
На другому етапі встановлювали глибину процесу шляхом визначення
продуктів гідролізу за йодною пробою.
Схема експериментальної лабораторної установки, на якій відтворювався
процес гідролізу кукурудзяного крохмалю у присутності в якості каталізатора
сульфатної і хлоридної кислот, зображена на рисунку 1.
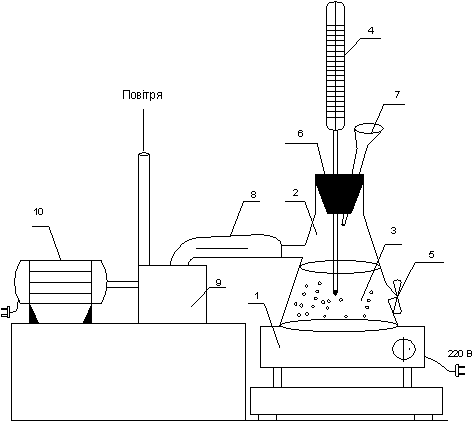
1 – електрична піч; 2 – гідролізер; 3 – крохмальне молоко; 4 –
термометр; 5 – кран для взяття
проби; 6 – пробка; 7 – лійка; 8 – з'єднувальний шланг;
9
– насос; 10 – електродвигун насоса
Рисунок 1 – Схема
експериментальної лабораторної установки
Для проведення експерименту готували крохмальну суспензію. Концентрацію
суспензії перевіряли денсиметричним методом. Для підкислення приготовленої
крохмальної суспензії додавали у першому випадку 0,1 н. розчин сульфатної
кислоти у кількості 1/3 від загальної кількості кислоти, необхідної для
гідролізу, а в другому випадку - таку ж кількість 0,1 н. розчину хлоридної
кислоти.
Приготовлену підкислену крохмальну суспензію концентрацією 40,0 – 43,0
0Бр ( густина ρ = 1,1764 – 1,1921 г/см3 )
заливали через лійку 7 у гідролі-зер 2, в якому на той час інтенсивно кипіла
вода. У воду додавали в першому випадку 0,1 н. розчин сульфатної кислоти у
кількості 2/3 від загальної кількості кислоти, необхідної для гідролізу, а в
другому випадку – таку ж кількість 0,1 н. розчину хлоридної кислоти. Для підтримки кипіння використовували електричну піч 1 з можливістю регулювання нагріву. Під
час розчинення крохмалю суміш в гідролізері перемішували скляною паличкою, щоб
запобігти місцевим перегрівам біля дна гідролізера і підгорянню крохмалю, крім
того це дозволило запобігти утворенню грудочок клейстеру та прискорило процес розчинення.
Швидкість гідролізу та глибину його контролювали шляхом взяття йодної проби
через кран 5 кожні 10 хвилин. Через
шланг 8, який з’єднаний з насосом 9,
забезпечували нормований тиск в гідролізері. Закінчення процесу гідролізу
встановлювали за йодною пробою.
Продукти гідролізу крохмалю з йодом змінюють забарвлення проби в наступній
послідовності:
синє → синьо-фіолетове → фіолетове →
червоно-жовтогаряче → жовтогаряче → жовте.
Відомо, що синій колір – це крохмаль, синьо-фіолетовий – це
декстрини, фіолетовий – еритродекстрини,
червоно-жовтогарячий – мальтоза, жовтогаря-
чий – патока, жовтий –
глюкоза.
За проведеними дослідами отримані
результати представили у вигляді графічних залежностей ступеня оцукровування
крохмалю від: концентрації крохмальної суспензії рис. 2, температури – рис. 3 та
тривалості процесу при однакових концентраціях сульфатної і хлоридної кислот –
рис. 4.
З рисунка 2 видно, що концентрація
крохмальної суспензії відіграє важливу роль при проведенні процесу. У
дослідженому діапазоні ступінь оцукровування можна збільшити при підвищенні
концентрації крохмального молока. Якщо в якості каталізатора гідролізу крохмалю
використовувати 0,1 н. розчин H2SO4 , то при ступені оцукровування крохмалю 80 % або за
шкалою продуктів гідролізу це є патока, концентрація крохмальної суспензії
становить 44,5 0Бр, а якщо в якості каталізатора використовувати 0,1
н. розчин HCl,
то при ступені оцукровування крохмалю 80 % концентрація крохмальної суспензії
становить 45,5 0Бр. Отже, з отриманих результатів можна зробити
висновок, що в якості каталізатора гідролізу крохмалю в даному випадку
ефективніше використовувати 0,1 н. розчин HCl, оскільки це дозволяє отримати
більш кон-
центровану крохмальну суспензію.
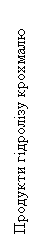
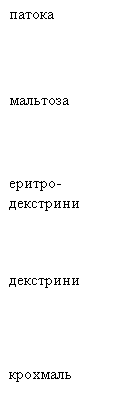
![]()

1 – 0,1 н. розчин H2SO4;
2 – 0,1 н. розчин HCl.
Рисунок
2 – Залежність ступеня оцукровування крохмалю від концентрації крохмальної
суспензії
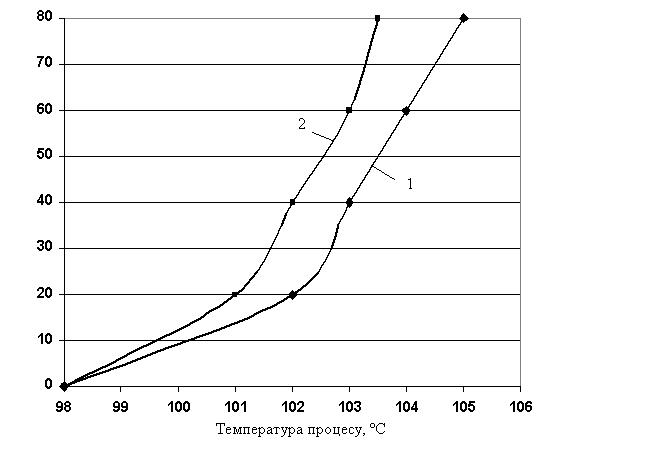
Із залежності
ступеня оцукровування крохмалю від температури протікання процесу,
рисунок 3, видно, що визначальним фактором швидкості процесу гідролітичного
розкладання крохмалю є температура. У випадку, коли в якості каталізатора гідролізу
крохмалю використовували 0,1 н. розчин H2SO4, патока утворювалася
при температурі 105 0С, а коли в якості каталізатора
використовували 0,1 н. розчин HCl, то патоку одержували вже при температурі 103,5 0С.
Отримані результати свідчать про те, що в даному випадку у якості каталізатора гідролізу
крохмалю також ефективніше використовувати 0,1 н. розчин HCl, так як це дозволить
зменшити енерговитрати, що дуже важливо у наш час.
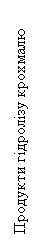
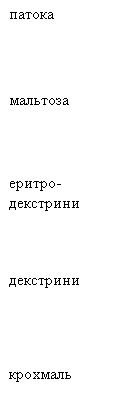
![]()

1 – 0,1 н. розчин H2SO4;
2 – 0,1 н. розчин HCl.
Рисунок
3 – Залежність ступеня оцукровування крохмалю від температури процесу
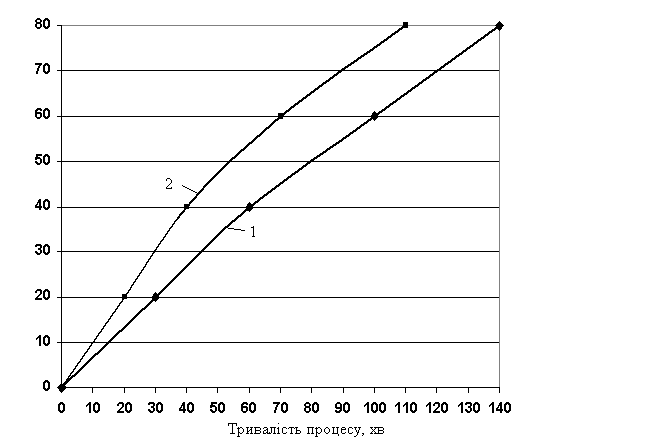
Розглядаючи
залежність ступеня оцукровування крохмалю від тривалості процесу при однакових
концентраціях сульфатної і хлоридної кислот, рису- нок 4, можна сказати, що у разі використання в якості
каталізатора 0,1 н. розчину H2SO4 процес гідролізу крохмалю йде значно повільніше у
порівнянні з використанням 0,1 н. розчину HCl. Як видно з графіку,
використовуючи 0,1 н. розчин HCl патока утворюється вже через 110 хвилин після початку
процесу гідролізу, а у присутності 0,1 н. розчину H2SO4 утворення патоки відбувається
лише через 140 хвилин, тобто процес триває на 30 хвилин довше. Одержані результати
свідчать про те, що використання 0,1 н. розчину HCl у якості каталізатора гідролізу
крохмалю дає можливість заощадити не тільки час,
а й витрати на електроенергію, які необхідні для проведення процесу.
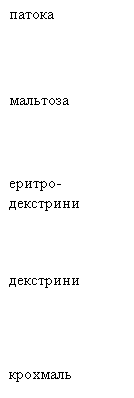
![]()

1 – 0,1 н. розчин H2SO4;
2 – 0,1 н. розчин HCl.
Рисунок
4 – Залежність ступеня оцукровування крохмалю від тривалості процесу при
однакових концентраціях H2SO4 і HCl
Проаналізувавши
одержані результати досліджень та їх графічні залежності можна зробити
висновок, що в якості каталізатора гідролізу
крохмалю ефективніше і раціональніше
використовувати хлоридну кислоту.
ЛІТЕРАТУРА:
1. Технология крахмала и крахмалопродуктов/ Под
ред. Н.Н. Трегубова.– 5-е изд., перераб. и доп. – М.: Легкая и
пищевая промышленность, 1981. – 472 с.
2. Голубев В.
Н. Пищевые и биологические активные добавки: Учеб. пос. для студентов вузов. –
М.: МАЙК «Наука», 2003.