ХИМИЯ И ХИМИЧЕСКИЕ ТЕХНОЛОГИИ/8. Кинетика и катализ
к.т.н.,
проф. КВАСКО М. З., к.т.н., доц. ЖУРАКОВСЬКА О.С., ст.викл. ЖУРАКОВСЬКИЙ Я. Ю.
Національний технічний університет України «Київський
політехнічний інститут», Україна
Дослідження однокомпонентної адсорбції газів HFC 134 та HFC
134A на цеолітах NaX, NaY і CsY
Адсорбція газів і парів знайшла
широке застосування при їхньому очищенні, осушенні, поділі, при гетерогенному
каталізі на поверхні поділу фаз.
Кількість речовини, адсорбована
ваговою або об'ємною одиницею поглинача, залежить від температури процесу і від
концентрації речовини в парогазовій суміші або розчині, що поглинається,
стикаючись з поглиначем. При сталій температурі, можна побудувати криву
досягнення стану адсорбційної рівноваги, називану ізотермою адсорбції. Характер
ізотерми адсорбції залежить від природи поглинача і речовини, що поглинається, а
також від температури процесу. Знання ізотерм адсорбції важливе при розрахунку
адсорбційних установок та для вибору оптимального.
У якості адсорбентів
застосовуються речовини, що мають велику питому поверхню. Активність
адсорбентів характеризується кількістю речовини, що поглинається одиницею
їхньої маси або об'єму. Останнім часом широке застосування в промисловості
знайшли молекулярні сита або цеоліти, наприклад синтетичні цеоліти натрієвої і
кальцієвої форми. Перевага цеолітових молекулярних сит - можливість чіткого
поділу речовин на підставі різниці в розмірах їхніх молекул.
Рівновагу адсорбції, що змальовує
навантаження газу в залежності від температури і парціального тиску, вимірюють
за допомогою об'ємометричного, гравіметричного, або методу нерухомого шару [1].
У даному випадку був використаний
гравіметричний метод, реалізований за допомогою спеціальних ваг, виготовлених
фірмою Cahn. При гравіметричному методі вимірюється приріст ваги адсорбенту.
Основою експериментальної
установки (рис. 1) є електричні мікроваги. Вони функціонують за принципом
підоймових ваг і мають дві вимірювальні чаші. На одній чаші знаходиться
адсорбент, на іншій - противага для врівноважування балок. Зміна ваги, що
відбувається в адсорбенті під час процесу адсорбції, врівноважується за
допомогою магнітної котушки. Відповідна електромагнітна сила пропорційна
набраної ваги й у підсумку впливає на зміну показання ваг. Для усунення
температурного впливу на електроніку і механіку ваг, ця частина ваг ізольована
і за допомогою охолоджуваної води знаходиться при постійній температурі 28,4
°С. Чаша з адсорбентом оточена резервуаром стійким до тиску, куди може
надходити досліджуваний газ за допомогою системи трубок. Тиск усередині
резервуара вимірюється і задається за допомогою електромагнітного вентиля.
Обидві чаші ваг знаходяться у водяній ванні з термостатом, що підтримує задану
температуру адсорбції.
Установка містить у собі також
газову впускну систему. З балона досліджуваний газ проходячи через редуктор
тиску потрапляє в регулятор масової витрати, який показує об'ємну витрату газу
і підтримує задане значення. Витрата проточного повітря (використовується при
малих тисках) регулюється в тому ж масовому співвідношенні. Осушене повітря
проходить через молекулярні сита, де звільняється від останніх забруднень і
часток вологи. Обидва гази залишають установку через випускний вентиль.
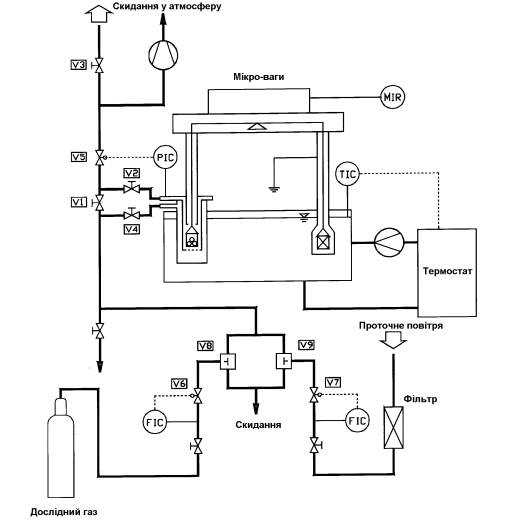
Рис. 1. Схема
дослідної установки
Ваги були оснащені механізмом компенсації
ваги, який дозволяє усувати проблему виходу величини що вимірюється за межі діапазону
вимірювання. Результати виводилися на цифровий індикатор і фіксувалися.
Досліджувались моделі, що описують
однокомпонентну адсорбцію HFC 134 та HFC 134a (табл. 1) на цеолітах NaX, NaY і
CsY. Дослідження проводилися при температурах в діапазоні 50-93°С.
В результаті досліджень були
отримані ізотерми адсорбції дослідних речовин (рис. 2). Була проведена
попередня обробка результатів із визначенням параметрів відомих моделей
адсорбції, таких як модель Тота, Дубініна-Астахова та моделі статистичної
термодинаміки [2].
Таблиця 1. - Параметри
дослідних величин
|
Речовина |
|
HFC 134 |
HFC 134a |
|
Критична температура |
Tc, [ K ] |
391,8 |
374,3 |
|
Критичний тиск |
Pc, [ Pa ] |
4640000 |
464000 |
|
Температура кипіння при нормальному тиску |
Tnbp, [ K ] |
253,55 |
246,65 |
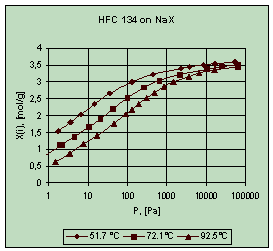
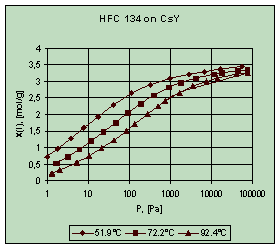
Рис. 2. Результати
експериментів для HFC 134
Найбільш адекватний опис
однокомпонентних кривих рівноваги для даних речовин дали моделі Тота (Toth) та
Дубініна-Астахова.
Висновки
У роботі був запропонований
гравіметричний метод, як найбільш простий та такий, що дає безпосередню
інформацію про протікання процесу. Були отримані експериментальні дані. Отримані
результати можуть бути використані подальших досліджень та проектування адсорбційних
установок.
Література
1. Kast, W.: Adsorption aus der
Gasphase - Grundlagen und Verfahren, Chem.-Ing.- Tech. 53 (1981), Nr. 3, S.
160-172
2. Mersmann, A.: Thermische
Verfahrenstechnik: Grundlagen und Methoden, Springer Verlag, Berlin, Heidelberg,
New York, 1980