Акимбаева А.К., Кухар
Е.В., Сураншиев Ж.А., Акибеков О.С.
Казахский
агротехнический университет им. С.Сейфуллина,
Астана,
Казахстан
Иммунохимическая
характеристика моноклональных антител, полученных к возбудителю рубромикоза
В настоящее время в общем
числе грибов, выделяемых из пораженных ногтей на территории России, на долю дерматомицетов
приходится около 85% [1]. В странах Европы и Северной Америки более 20 видов
дерматомицетов вызывают поражение ногтевых пластинок, но наиболее часто
встречается дерматомицет Trichophyton rubrum (85-95%). Несмотря на
большие успехи в лечении и профилактике грибковых инфекций, онихомикозы
остаются весьма актуальной проблемой, особенно у пожилых людей, число которых в
развитых странах неуклонно возрастает [2, 3].
Руброфитию первым
наблюдал А.А. Боголепов в 1930 году. Первые клинические случаи микоза,
вызванного красным трихофитоном, были подробно описаны в 1945 г. А.М. Ариевичем
и В.Н. Пентковской. Среди многочисленных возбудителей дерматомикозов Trichophyton rubrum занимает первое место, как в странах
Европы, так и в России. Он также лидирует и по степени контагиозности для
человека. Будучи антропофилом, этот гриб способен поражать кожу стоп (80-85%
микозов стоп обусловлено именно T. rubrum), кистей и других частей тела, реже
– крупных складок, а также ногти и пушковые волосы [4].
Онихомикозы могут существенно
ухудшать качество жизни больного, поскольку приводят к деструкции ногтя,
зачастую обезображивающей их, к болевым ощущениям различной природы, к
социальным и психологическим стрессам, вызывают чувство озабоченности, тревоги,
депрессию [2, 3].
На сегодняшний день существуют
следующие методы диагностики дерматомикозов: микроскопия кожных чешуек из
очагов поражения, соскобы с пораженного ногтя; посев материала из очагов
поражения; определение чувствительности к антимикотикам при рецидивирующем течении
и/или резистентности к стандартной антимикотической терапии. Но, согласно
данным ряда ведущих исследователей, процент расхождения диагнозов может
достигать более чем 30% от числа обследованных [5]. В
связи с этим, вопросам диагностики дерматомикозов посвящены многочисленные
современные работы, появление которых, к сожалению, до сегодняшнего дня не
решило данную проблему. Таким образом, существует необходимость разработки
более совершенных методов их диагностики, одним из которых является
использование моноклональных антител в иммуноферментном анализе.
Целью работы явилось изучение биохимических и иммунологических свойств моноклональных антител, специфичных к возбудителю рубромикоза.
Для достижения цели перед
нами были поставлены следующие задачи: получить препаративное количество МКА и
изучить их биохимические и иммунологические свойства: определить константу
связывания МКА, класс и подкласс моноклональных антител, определить
специфичность МКА к T. rubrum.
Методы исследования
В качестве антигена
использовали белковые компоненты клеточной стенки, выделенные из мицелия гриба T. rubrum методом L. Tabatabai (1979). Концентрацию белков в
полученном белковом антигене определяли по M. Bradford (1976).
Гибридизацию клеток миеломы Х 63/Ag8.653 со спленоцитами иммунных мышей
проводили по методу V. Oi et L. Herzenberg (1980).
Класс и подкласс моноклональных
антител определяли с помощью двойной иммунодиффузии по методу O. Ouchterlony (1958).
Константу связывания
моноклональных антител устанавливали по методу J. Beatty et al ().
Электрофорез моноклональных антител
осуществляли по методу Laemmli V.K. (1970) на аппарате для вертикального электрофореза (Hoefer Scientific, США) с использованием
трис-глицинового буфера [6].
Результаты
исследований
С целью получения
иммунных спленоцитов поверхностными белками T. rubrum были иммунизированы две группы мышей
линии BALB/c. Иммунизацию животных проводили по двухнедельной
схеме внутрибрюшинно в дозе 100 мкг/мл. Титры специфических антител в сыворотке
крови иммунизированных мышей достигали 1:6400-1:25600, что указывает на
активную индукцию клонов В-лимфоцитов, продуцирующих антитела заданной
специфичности.
Отбирали мышей с наиболее
высокими титрами антител, селезенки которых были использованы в качестве
источника иммунных лимфоцитов. Слияние клеток селезенки мышей осуществляли с
миеломными клетками линии Х 63/Ag 8.653. В качестве сливающего агента использовали 45% раствор
полиэтиленгликоля-4000. Для культивирования клеточных культур использовали
среду RPMI-1640 с добавлением 10% фетальной сыворотки теленка, 0,05 мг/мл пирувата
натрия, 0,003 мл/л 2-меркаптоэтанола.
В результате гибридизации
клеток миеломы Х63/Ag8.653 со спленоцитами иммунных мышей полученные гибридные
клетки, синтезируемые клоном гибридом 3С10, вводили в концентрации 2·10
внутрибрюшинно мышам линии BALB/c, которым предварительно, за 14 дней до
введения гибридомы, был инъецирован пристан – 2,6,10,14-тетраметилпентадекан («Sigma», США) в дозе 0,5 мл на голову.
Наблюдение за процессом асцитообразования у линейных мышей показало, что
формирование асцитной опухоли штаммами гибридом - продуцентов МКА происходит за
10-14 суток.
Очистку моноклональных
антител из асцитной жидкости осуществляли методом высаливания сульфатом аммония
до 50% насыщения. Для этого в асцитную жидкость добавляли равный объем ЗФР с рН
7,2. Затем добавляли равный объем насыщенного раствора сульфата аммония и
оставляли при перемешивании на 12 часов при 4°С.
Антитела осаждали при 5
000 об/мин в течение 30 минут при 4 °С. Осадок антител ресуспендировали в
минимальном объеме ЗФР с рН 7,2, помещали в диализную трубку («Serva», Германия) и диализовали против ЗФР
в течение суток. Очищенные моноклональные антитела в виде асцитной жидкости
хранятся при 70 °С без консервантов или при 4 °С с добавлением 0,1% азида
натрия. Концентрация антител в асцитной жидкости, которую определяли по методу М.
Бредфорда, составила 4 мг/мл.
Субкласс моноклональных
антител определяли в реакции диффузионной преципитации с моноспецифическими
антисыворотками («Sigma»). В результате было определено, что
синтезируемые гибридомой моноклональные антитела к дерматомицету принадлежат к
иммуноглобулинам класса G подкласса G1.
Результаты иммуноблотинга
показали, что моноклональные антитела к дерматомицету T. rubrum специфически реагировали с белками
молекулярная масса которых составила 45 кДа. Результаты иммуноблотинга
представлены на рисунке 1.
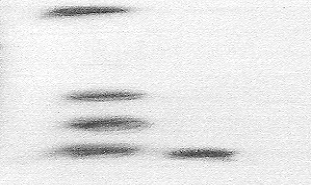 маркеры проба
маркеры проба
13
24
35
45
Рисунок 1 – Электрофореграмма белкового антигена (L. Tabatabai, 1979) дерматомицета T. rubrum. Молекулярная масса использованных маркеров:
13 кДа – cytochrome, 24 кДа – chymotrypsinogen,
35 кДа – albumin, 45 кДа – ovalbumin .
Как видно из рисунка 1, молекулярная масса антигенной фракции белка, взаимодействующей с моноклональными антителами находится на уровне белковой линии маркера с молекулярной массой 45 кДа.
Одним из важных свойств
моноклональных антител является аффинность, которая характеризует уровень
сродства антитела к испытуемому антигену, т.е. степень совпадения
(комплементарности) конфигураций активного центра антитела и антигенной
детерминанты. Аффинность может быть количественно изменена с помощью
определения константы связывания. Константу связывания моноклональных антител
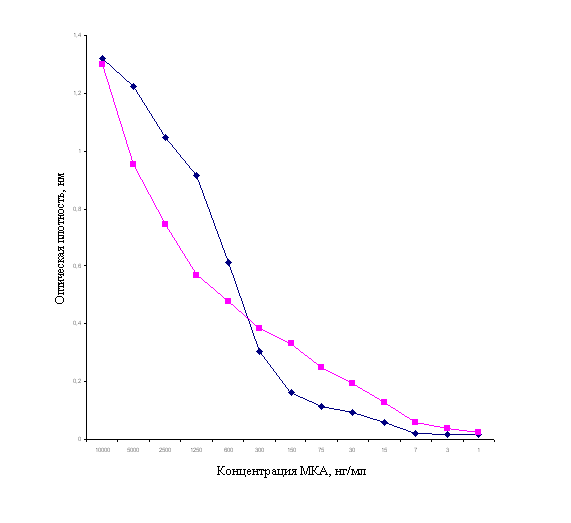
определяли непрямым вариантом иммуноферментного анализа (рисунок 2). На основе
полученных данных строили графики – кривые
Показатель константы
связывания моноклональных антител составил 5·107, что
свидетельствует о высокой степени совпадения конфигураций активного центра
антитела и антигенной детерминанты.
Рисунок 2– Определение константы связывания моноклональных антител.
Синим цветом отмечена концентрация антигена в 600 нг,
розовым – 300 нг.
Как видно из рисунка 2,
концентрация моноклональных антител, связывающих 50% антигена различна. Так,
например, согласно рисунку, концентрация моноклональных антител к
дерматомицету, связывающих 50% антигена составляет 600 и 300 нг. При этом линия
1 является кривой реакции моноклональных антител с оптимальной концентрацией
антигена, а линия 2 – кривой реакции моноклональных антител с концентрацией
антигена ниже оптимальной.
В дальнейших исследованиях проводился контроль активности и специфичности, полученных МКА в ИФА (таблица 4).
Таблица 4 – Изучение специфичности и
активности МКА, продуцируемых штаммом гибридомы 3С10
|
№ п/п |
Виды антигенов |
Обратные величины титров
моноклональных антител |
|
|
в культуральной жидкости |
в асцитной жидкости |
||
|
1 |
Белковый антиген T. rubrum |
1:12800 |
1:12800 |
|
2 |
Белковый антиген T. gypseum |
1:200 |
1:100 |
|
3 |
Белковый антиген T. verrucosum |
1:6400 |
1:3200 |
|
4 |
Белковый антиген Т. faviforme |
1:200 |
1:100 |
|
5 |
Белковый антиген T. autotrophycum |
1:3200 |
1:3200 |
Как видно из таблицы 4,
моноклональные антитела, продуцируемые штаммом гибридомы 3С10, активно
взаимодействуют с антигеном гриба T. rubrum и дают показания титров антител до
1:12800, что на два порядка и выше показателей титров антител, выявляемых
другими антигенами. Также видно, что специфичность асцитной жидкости на порядок
выше, чем культуральной жидкости.
Следует отметить, что
МКА, полученные к белковому антигену гриба T. rubrum, вступают в перекрестную реакцию с
аналогичными антигенами других представителей рода Trichophyton., что
говорит о их родоспецифичности.
Выводы
Таким образом, в
результате проведенной работы изучены биохимические и иммунологические свойства
моноклональных антител к грибу T. rubrum.
Установлено, что
полученные МКА принадлежат к иммуноглобулинам класса G, характеризуются показателем
константы связывания моноклональных антител равным 5·107
М и показанием титров антител в непрямом варианте ИФА до 1:12800.
Литература
1
Сергеев
Ю.В., Сергеев А.Ю. Онихомикозы: современные подходы к лечению. Новый мед.
журнал, 1997; 2
2
Бычкин
П.В., Гительсон С.С., Агабабова Н.Б. «Практикум по микробиологии», «Колос», Москва,
1964. С.
3
Summerbell R. Epidemiology and
Ecology of onychomycosis. Dermatology 1997; 194: Suppl: 32 - 36.
4
Greer D. Evolving role of
non-dermatophytes in onychomycosis. Int. J. Dermatol. 1995; 34: 521 - 524.
5
Умбетьярова
Л.Б. Детская проблема г. Алматы. Успехи медицинской микологии, № 4, 2004. С. 6-12.
6
Фридлянская
И.И. Получение моноклональных антител (гибридомная технология). Методы
культивирования клеток. Л.; Наука. 1987. – С. 194-205.
the immunochemical characteristic of monoclonal antibodies produced to
the activator Rubromicosis
In the article are studied
biochemical and immunologic properties of monoclonal antibodies to fungus T.
rubrum which belong to antibodies of class G 1, are characterized by a
parameter of a constant of linkage monoclonal antibodies equal 5•107 M. Activity
and specificity Мab
synthesized by a hybrid clone 3С10
in relation to various antigenes, have been studied by means of immunoblot
therefore was interaction monoclonal antibodies with fibers of an antigene with
molecular weight 45 кД
is revealed.
Заявка
на участие
в работе научной конференции «Научный
прогресс на рубеже тысячелетий - 2008», которая будет проводиться с 14-15 июня
2008 года (Чехия, Прага)
|
Фамилия, имя, отчество |
Акимбаева Айнур
Курманбековна |
|
Ученая степень, ученое звание, должность |
аспирант Национального центра по
биотехнологии Республики Казахстан, г. Астана |
|
Контактные телефоны |
8-701-458-18-57 (моб) 8-717-2-38-36-57 (раб) |
|
Адрес |
010011, г. Астана, пр.
Победы, 62 |
|
|
|
|
Секция |
Инфекционные болезни |
|
Название доклада |
Иммунохимическая
характеристика моноклональных антител, полученных к возбудителю рубромикоза |
|
Язык доклада |
русский |
Подпись участника конференции
_______________________
Дата: 13.05.2008