1Абуляисова Л.К., 2Алимбаева М.Т., 1Сарсенбекова
А.Ж.
1Карагандинский государственный
университет им. Е.А.Букетова,
ул. Университетская, 28, г. Караганда, Казахстан
2Химико-металлургический институт им. Ж.Абишева,
ул.Ермекова, 63,
г. Караганда, Казахстан
Электронный эффект
заместителей и вращательная изомерия мезогенных эфиров
Теоретическое изучение конформаций не исследованных экспериментально молекул
позволяет a priori определять их оптимальные конформации и геометрические параметры.
Неэмпирический расчет конформаций пара-замещенных фенилпропаргиловых
эфиров фенолов с полной оптимизацией длин связей, валентных и двугранных углов
экономически не оправдан. Поэтому в первом приближении расчет проводили
полуэмпирическим методом PM3 [1].
Для родственных
молекулярных структур п-XC6H4OR (R = CH2CCC6H5), различающихся только пара-заместителем (X = H, F, Cl, Br, I, COOH, CHO, CN, NO2) получены: набор конформаций
молекул, их геометрические характерис-тики, ряд
относительного изменения барьеров внутреннего вращения вокруг связи Csp2-O. Варьирование заместителей приводит к наиболее заметному
уменьшению длины связи Csp2-O, являющейся проводником сопряжения (особенно в случае
электроноакцепторных заместителей, что подтверждает их большую способность к
сопряжению), и искажению Z –конформации молекул.
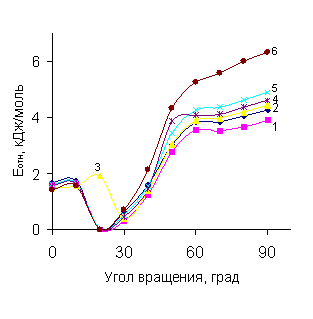
По результатам расчетов форма
потенциальной кривой вращения ФПЭ пара-цианфенола подобна форме кривых для незамещенного и галогензаме- щенных эфиров (рис.1,а), несмотря на то, что
они проявляют разные электронные эффекты: CN-группа – мезомерный
электроноакцепторный, галогены – электронодонорный.
Очевидно, благодаря линейному строению циангруппы (по сравнению с
разветвленными акцепторными группами) вращение в CN-эфире сходно с внутренним вращением
в молекулах с электронодонорными заместителями.
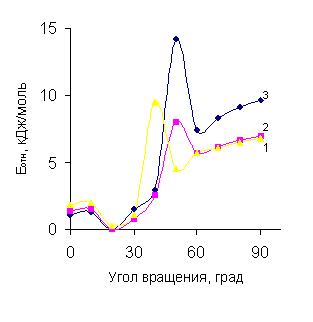
Для молекул эфиров с акцепторными
группами изменение энергии вращения имеет иной вид (рис.1, б).
а
б
Рис. 1. Профиль потенциальной энергии
для вращения по связи Csp2-O в
молекулах ФПЭФ c заместителями п-X: а) 1 - F, 2 - H, 3 - Cl, 4 - I, 5 –
Br, 6 - CN; б) 1 - CHO,
2 - COOH, 3 - NO2.
Нельзя не обратить внимания на то,
что барьеры вращения увеличиваются в точном соответствии с возрастанием
резонансных σ-констант заместителей (кроме CN):
п-заместитель, X F
H Cl I
Br CN COOH
CHO NO2
Eотн, кДж/моль 3,90
4,28 4,44 4,61
4,89 6,34 8,02 9,53 14,20
σ
[2] -0,073 0
0,114 0,135 0,150
0,659 0,421 0,465
0,790
Говоря словами В. Кона, «как точно
теоретические результаты согласуются с довольно нерегулярной
последовательностью экспериментальных данных».
Для того чтобы выявить степень
влияния стерического фактора на величину и форму
барьера вращения мы исключили пространственные затруднения, заменив ФПЭФ
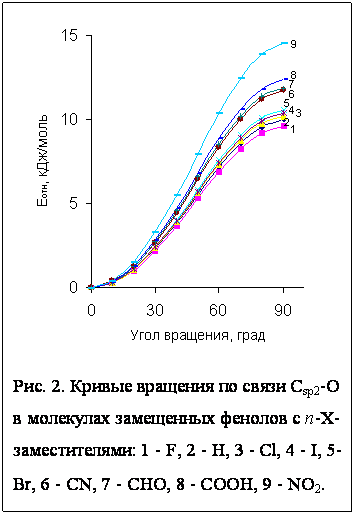
молекулами замещенных фенолов п-XC6H4OH. Как оказалось, энергетические функции для внутреннего враще-ния в фенолах схожи для молекул и с донорными, и с акцепторными заместителями (рис.2). Порядок
следования барьеров не изменил-ся, за
исключением CHO- и
COOH-групп (обратный в их случае). Однако их величина в 1,5-3 раза
больше, а крайними кон-формациями здесь являются
плоская и ортогональная. Для ФПЭФ минимум смещен на 20-30° вправо, в случае же
акцепторных заместителей и максимум сдвинут на 40-50° влево (рис. 1).
 Следовательно, в формирова-нии оптимальной конформации
молекул ФПЭФ доминирующую роль играет не электронный эффект и сопряжение
заместителей, а стерический фактор.
Следовательно, в формирова-нии оптимальной конформации
молекул ФПЭФ доминирующую роль играет не электронный эффект и сопряжение
заместителей, а стерический фактор.
Во втором приближении
оптимизированная геометрия будет использована в неэмпирических расчетах для уточнения энергий конформеров.
Список
литературы
1.
Stewart J.J.P. // J. Comput. Chem. 1989. № 10. - P.
209.
2. Гаммет Л. Основы физической органической химии. М.: Мир, 1972. 534 с.