Химия и химические технологии / 5.
К.т.н.
Родионов И.В.
Саратовский государственный технический
университет
Характеристики биомеханической совместимости оксидных покрытий медицинских титановых имплантатов, полученных анодной обработкой в сернокислых электролитах
Медицинские костные имплантаты широко применяют в ортопедической имплантологии при лечении различных костных патологий. При этом взаимодействие биотканей с имплантатами комплексно связано с биологической и механической совместимостью имплантационных материалов, которая определяется уровнем их биологических, физико-химических и механических свойств. Уровень биосовместимости материалов, в свою очередь, обусловливается характером их взаимодействия с биотканями и определяется способностью к адаптации в организме при физико-химическом воздействии различных биоструктур. Поэтому основными характеристиками биологической совместимости материалов является их фазовый и элементный составы, а также сопротивление коррозионному разрушению.
Участие имплантата в выполнении
механических функций кости предъявляет к нему требования механической
совместимости, при которой его механическое взаимодействие с костью не создает
в материале имплантата и в костной ткани напряжений, вызывающих недопустимые деформации,
разрушения или воспаление биоткани.
Уровень механической совместимости имплантата зависит от необходимого сочетания механических свойств его материала, жесткости и рациональности конструкции, схемы расположения имплантатов в системе. Данные факторы выбираются в соответствии с механическими характеристиками кости и функциональными нагрузками на имплантат. По приведенным основаниям для костных имплантатов и систем используются биосовместимые материалы с повышенным модулем упругости при высоких значениях изгибной жесткости имплантата и коэффициента жесткости его конструкции. Кроме этого, материал должен обладать увеличенным пределом текучести, минимальной допустимой пластичностью и оптимальной прочностью, необходимой выносливостью, твердостью и износостойкостью. В наибольшей степени указанным требованиям удовлетворяют металлические биоинертные сплавы Ti, Zr, Co-Cr, нержавеющие хромоникелевые стали. Полимерные органические и неорганические материалы не обладают необходимым комплексом механических свойств, чтобы при действии на имплантат функциональных нагрузок обеспечивать появление только малых упругих деформаций. Поэтому они не используются для изготовления несущей основы имплантатов, за исключением углеродного композита, применяемого для некоторых видов имплантатов при остеосинтезе.
Придание высокого уровня биосовместимости механически
совместимым имплантационным материалам достигается за счет создания оксидных биопокрытий на металлоимплантатах
путем их электрохимической обработки. Ее совершенствованию способствовало создание новых электролитов и
способов обработки изделий, позволяющих получать покрытия не только с высокими
твердостью, износостойкостью, адсорбционной способностью, хорошими диэлектрическими
свойствами, но и качествами биосовместимости. Поэтому целью работы являлось
создание биомеханически совместимых покрытий на
широко распространенных титановых имплантатах путем сернокислотного анодирования.
Методика
исследования. Образцами
являлись пластины из титана ВТ1-00, поверхность которых подвергалась пескоструйной
обработке для формирования исходной шероховатости и активации при окислении. Анодирование образцов осуществлялось в электролитах №1 – 200
г/л Н2SO4 и №2 – 200
г/л Н2SO4 + 50 г/л CuSO4 · 5 Н2О. Добавлением в сернокислый
электролит №2 сульфата меди CuSO4
обеспечивалось повышение скорости роста толщины оксидного покрытия за счет
активирующего действия ионов Cu на
титановый анод. Оксидирование проводилось при значениях анодной плотности тока
5-50 мА/см2, температуре сернокислых
электролитов 25, 35, 45, 550С и продолжительности процесса 20-50
мин.
Исследование физико-химических и механических свойств титанооксидных покрытий, определяющих уровень
биомеханической совместимости анодированных имплантатов, осуществлялось
установлением характеристик фазового состава, толщины, шероховатости
поверхности, морфологии, коррозионного поведения, микротвердости
и адгезии покрытий.
Результаты исследования и их анализ. Фазовый
состав. При анодировании образцов в сернокислом
электролите №1 формируется покрытие из смешанных биоинертных
оксидов титана с общим составом TiO2 и
примесями TiO, Ti2O3. При этом такой состав оксидных фаз характерен для
покрытий, полученных при всех задаваемых в эксперименте значениях режима
электролиза. Основную массу покрытия составляет преимущественно фаза диоксида
титана TiO2, состоящего
из трех разновидностей – рутил, анатаз, брукит с небольшим количеством других оксидных фаз – TiO, Ti2O3. Анодирование
титана в электролите с добавкой CuSO4 создавало
покрытие состоящее также, в основном, из оксидных фаз титана
нестехиометрического состава TiO2-х при х<<1 с небольшим содержанием TiO, Ti2O3 и СuО. Последняя фаза является следствием присутствия в
сернокислом электролите катионов Cu2+ в
результате чего при электролизе происходит образование примесного
оксида СuО и
включение небольшого количества его частиц в состав титанооксидного
покрытия. Это говорит о незначительном содержании оксида меди в покрытии и его
слабом влиянии на свойства титанооксидного слоя.
Таким образом, сернокислотное анодирование
титана позволяет получить биопокрытие с высокой
однородностью фазового состава, создать необходимый уровень биологической
совместимости оксидированных имплантатов с костной тканью, а также сформировать
благоприятные условия для их биоинтеграции и эффективного
функционирования.
Толщина. В табл. 1 приведены результаты
определения толщины покрытий в зависимости от режимов анодной обработки.
Таблица 1
Влияние
режимов и условий сернокислотного анодирования титана
на изменение
толщины оксидных покрытий
|
Электролит №1 |
Электролит №2 |
||||
|
Температура , 0С |
Температура , 0С |
||||
|
25 |
35 |
55 |
25 |
35 |
55 |
|
Анодная плотность
тока, мА/см2 |
Анодная плотность
тока, мА/см2 |
||||
|
5 |
15 |
50 |
5 |
15 |
50 |
|
Толщина покрытия, мкм |
Толщина покрытия, мкм |
||||
|
10 |
10 |
20 |
10 |
20 |
50 |
|
Продолжительность анодирования, ч |
Продолжительность анодирования, ч |
||||
|
6 |
2 |
0,9 |
4 |
2 |
0,3 |
Из
приведенных данных следует, что основное влияние на процесс роста толщины титанооксидных покрытий оказывает анодная плотность тока
при небольшом влиянии температуры электролита. Кроме того, присутствие в сернокислом
электролите добавки CuSO4
способствует ускоренному росту толщины покрытия до приемлемых для эффективной биоинтеграции и механической совместимости значений при
невысокой продолжительности обработки.
Шероховатость. Профилометрическое
измерение параметров микронеровностей оксидных
покрытий, полученных анодированием пескоструйно обработанного титана в используемых
сернокислых электролитах, показало, что оксидированная поверхность имеет
высокую степень шероховатости, зависящую от толщины слоя металлооксида.
Так, анодированием титана в электролите №1 при
наибольшей анодной плотности тока 50 мА/см2,
температуре 550С и продолжительности 0,9 ч, создавалось покрытие
толщиной 20 мкм, имеющее значения неровностей Ra=1,10 мкм, Rz=2,50 мкм, Rmax=5,50 мкм, Sm=14 мкм близкие
к параметрам рельефа поверхности после пескоструйной обработки. Это
характеризует незначительное влияние указанной толщины покрытия на изменение
исходной шероховатости пескоструйно обработанной
титановой основы при сохранении благоприятного для биоинтеграции
рельефа поверхности покрытия. Анодированием титана в
электролите №2, при аналогичном режиме, получалось покрытие толщиной 50 мкм с
параметрами Ra=1,35 мкм, Rz=2,80 мкм, Rmax=6,20
мкм, Sm=10,20 мкм обусловливающими повышение значений высоты
неровностей и уменьшение шага выступов. Это, в первую очередь, связано со
значительной толщиной покрытия, которая, во-первых, приводит к некоторому
сглаживанию рельефа и соответственному снижению шага неровностей Sm, во-вторых, способствует
фрагментации покрытия на микровыступах, за счет его растрескивания, и характерному увеличению параметров высоты
Ra, Rz, Rmax. Данные особенности создают повышенную структурную гетерогенность поверхности толстых оксидных слоев,
получаемых при больших значениях анодной плотности тока. Малые значения тока не
обеспечивают формирование покрытий существенной толщины из-за того, что реакция
анодного растворения в таких условиях потребляет почти половину электричества,
пропускаемого через анод при оксидировании, а также приводит к сглаживанию рельефа
поверхности и снижению степени шероховатости (табл. 2).
На
данном основании можно считать, что для получения шероховатых оксидных покрытий
имплантатов приемлемой для биоинтеграции толщины необходимо
осуществлять электролиз при повышенных значениях анодного тока.
Таблица 2
Изменение
шероховатости поверхности анодно-оксидных покрытий титановых образцов,
обработанных в сернокислых электролитах при t=550С, τ=0,9 ч и различной плотности тока i
|
Анодная плотность тока i, мА/см2 |
Толщина покрытия h, мкм |
Параметры шероховатости, мкм
|
||||
|
Ra |
Rz |
Rmax |
Sm |
|||
|
Электролит №1 |
5 |
10 |
0,84 |
1,70 |
3,70 |
7,60 |
|
50 |
20 |
1,10 |
2,50 |
5,50 |
14,00 |
|
|
Электролит №2 |
5 |
20 |
0,75 |
1,94 |
3,90 |
8,10 |
|
50 |
50 |
1,35 |
2,80 |
6,20 |
10,20 |
|
Из анализа профилометрических результатов следует, что толщина оксидных покрытий является определяющей характеристикой, влияющей на изменение степени шероховатости поверхности анодированных титановых имплантатов, наибольшие значения которой присущи более толстым покрытиям, созданным в электролите №2.
Морфология. Сравнительный оптический анализ поверхности
покрытий показал, что анодирование пескоструйно обработанного титана в электролите №2 приводит
к существенному изменению поверхностной структуры оксидного слоя с наличием
явно выраженных морфологических признаков и повышенной гетерогенности
(рис. 1). Кроме того покрытие, созданное в электролите №2, обладает более
высокой степенью открытой пористости и равномерностью распределения пор по
поверхности, чем обеспечиваются благоприятные условия протекания остеоинтеграционных процессов. Данные характеристики пористой
структуры покрытия обусловливаются повышенными значениями ее удельной
поверхности, находящимися в пределах 20-30 м2/г, и приводящими к
уменьшению нагрузки на единицу площади кости в контактной с покрытием зоне. Это
способствует наиболее равномерному распределению механических усилий по
поверхности покрытия, а также высокой надежности функционирования имплантата в
костных структурах.

Электролит №1 Электролит №2
Рис. 1. Поверхность
оксидного покрытия, полученного анодированием
пескоструйно обработанного титана при
i=50 мА/см2, t=550С, τ=0,9 ч (х300)
Таким образом, можно заключить, что сернокислотное анодирование пескоструйно обработанных титановых имплантатов создает покрытие с необходимыми параметрами морфологии поверхности, обеспечивающей прорастание костных клеток в структурные микронесплошности оксидного слоя и его интеграцию с окружающей тканью. Данное условие позволяет считать анодно-оксидное покрытие имплантатов биоинтеграционным, обладающим высокими качествами биомеханической совместимости.
Коррозионное поведение. Уровень
коррозионной стойкости покрытий оценивается по величине их электродных
потенциалов Ес, оказывающих главное
влияние на термодинамическую устойчивость покрытий в условиях электрохимической
коррозии. На данном основании осуществлялось измерение величины потенциалов
коррозии Ес анодно-оксидных покрытий
в и определялся характер ее изменения в зависимости от режима электролиза. Для
потенциометрических измерений использовались стандартная электрохимическая ячейка
и насыщенный хлорсеребряный электрод сравнения. В качестве коррозионной среды
использовался физиологический раствор 0,9% NaCl с рН=7,4, соответствующий по химическому
составу плазме крови и тканевой жидкости организма и моделирующий условия
нахождения имплантатов в биосреде человека.
Оценка потенциометрических
измерений зависимости сдвига потенциала от анодной плотности тока, температуры
электролита и продолжительности анодирования для
оксидных покрытий, полученных в различных электролитах показывает, что средняя
величина потенциала поверхности равна 0,17 и 0,15 В, соответственно обработке в
электролитах №1 и №2
Анализ результатов позволяет считать, что добавление CuSO4 в сернокислый электролит незначительно влияет на коррозионно-электрохимические свойства анодно-оксидного покрытия титана, уменьшая величину его коррозионного потенциала всего на 20 мВ.
Таким образом, проведенные
исследования указывают на достаточно высокую коррозионную стойкость
анодно-оксидных покрытий в биосредах.
Микротвердость. Костные титановые имплантаты испытывают не только биологическое, но и
механическое воздействие окружающей биосреды в течение
продолжительного времени. Поэтому для образование прочной функциональной
биотехнической системы «имплантат – кость» покрытию придают необходимое
сочетание адгезии, когезии,
пористости, морфологической гетерогенности поверхностного
строения. Определение данных параметров
требует применения специальных сложных методов исследования, и в то же
время их значения находятся во взаимосвязи с микротвердостью
покрытия. Вследствие этого можно проводить контроль качества получаемого
комплекса основных параметров механической совместимости покрытия путем использования
относительно простого метода определения микротвердости
(табл. 3).
Таблица 3
Результаты измерения микротвердости по толщине анодно-оксидных
покрытий, полученных
обработкой титана в сернокислых электролитах при i=50 мА/см2, t=250С, τ=25 мин
|
Микротвердость Нкв, ГПа |
Граница оксидного слоя с основой |
Нижний оксидный слой |
Середина оксидного слоя |
Внешний оксидный слой |
|
3 |
6 |
10 |
4 |
На основании проведенных
исследований можно заключить, что микротвердость титанооксидных покрытий имеет довольно большие значения,
характеризующие высокий уровень их механической прочности, необходимой для
эффективного функционирования анодированных имплантатов в костных структурах.
Адгезия. Исследование зависимости адгезии оксидных покрытий пластинчатых титановых образцов от продолжительности электролиза τ и анодной плотности тока i, показало, что величина адгезии монотонно уменьшается при повышении продолжительности обработки и увеличивается с возрастанием плотности тока, при этом такая закономерность изменения адгезии характерна для покрытий, полученных в обоих сернокислых электролитах (рис. 2, 3)
Анализ
результатов показывает, что с увеличением продолжительности анодирования
титана с 15 до 45 мин при плотности тока 30 мА/см2
и температуре электролита 250С происходит уменьшение величины адгезии с 26 до 11 МПа, что
обусловлено повышенной толщиной получаемых покрытий, сопровождаемой их высокой
структурной неоднородностью и низкой механической прочностью (рис. 2).
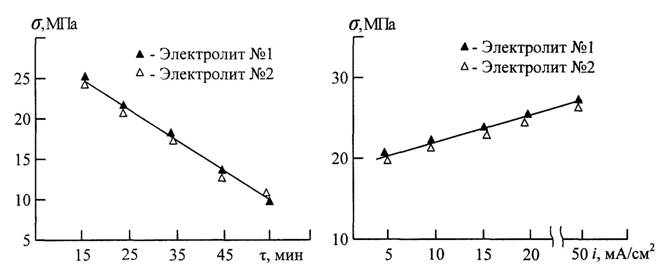 При
снижении продолжительности обработки до 20 мин и возрастании анодной плотности
тока до 50 мА/см2 формируется оксидное
покрытие с высокой структурной плотностью и хорошей поверхностной гетерогенностью, что говорит о необходимом качестве биопокрытия. Величина адгезии при
этом составляет 29 МПа, характеризует требуемый
уровень прочности сцепления покрытия с основой имплантата при достаточной для
эффективной биоинтеграции толщине оксидного слоя
(рис. 3)
При
снижении продолжительности обработки до 20 мин и возрастании анодной плотности
тока до 50 мА/см2 формируется оксидное
покрытие с высокой структурной плотностью и хорошей поверхностной гетерогенностью, что говорит о необходимом качестве биопокрытия. Величина адгезии при
этом составляет 29 МПа, характеризует требуемый
уровень прочности сцепления покрытия с основой имплантата при достаточной для
эффективной биоинтеграции толщине оксидного слоя
(рис. 3)
|
Рис. 2. Зависимость адгезии
оксидных покрытий от продолжительности τ анодирования титана при i=30 мА/см2 и t=250С в различных электролитах |
Рис. 3. Зависимость адгезии
оксидных покрытий от анодной плотности тока i
при обработке титана в
различных электролитах с τ=20 мин и t=250С |
Выводы
В работе рассмотрены основные
биомеханические характеристики покрытий костных титановых имплантатов,
полученных анодным оксидированием в сернокислых электролитах. Установлено
влияние режимов и условий анодной обработки титана на изменение показателей
физико-химических и механических характеристик оксидных покрытий, определяющих
эффективность функционирования имплантатов.