Химия и
химическая технология/8. Кинетика и катализ
Мельник
С.Р., Качмар-Кос Н.Я.
Національний
університет “Львівська політехніка”
Кінетичні аспекти естерифікації дикарбонових кислот
Діестери аліфатичних дикарбонових кислот використовуються як пластифікатори
полімерних матеріалів, лаків, фарб, висококиплячі розчинники тощо. Вони не
токсичні, добре сумісні з більшістю полімерів, забезпечують високу водо- та морозостійкість, стабільність
властивостей полімерів.
Вивчення кінетичних
закономірностей естерифікації дикарбонових кислот спиртами дозволить
використати одержані дані для моделювання та оптимізації технологічного процесу
і прогнозування хімічного складу продуктів реакції.
Експерименти вели у
закритій системі. У дослідженнях використовували: бурштинову кислоту (БК),
ізобутиловий (іБС), бутиловий, ізоаміловий, аміловий спирти, каталізатор – п-толуолсульфокислоту (п-ТСК).
Мольне співвідношення реагентів
кислота : спирт – 1 : (16-24). Температуру змінювали в діапазоні
343-363 К.
За умови великого надлишку спирту реакцію естерифікації можна описати
рівнянням першого порядку за кислотою, приймаючи, що порядок реакції за спиртом
– нульовий, а концентрація каталізатора та спирту входять в ефективну константу
швидкості, що відповідає схемі перетворень:
![]()
де К – кислота, КЕ –
моноестер, Е – діестер.
За таких
умов криві витрати кислоти лінеаризуються в координатах lnС(К)–τ, а тангенс кута нахилу прямої відповідає ефективній
константі швидкості (рис. 1). Дослідження проводили за різних співвідношень
реагентів 1:16, 1:20, 1:24, та за умови постійних інших параметрів процесу. Як
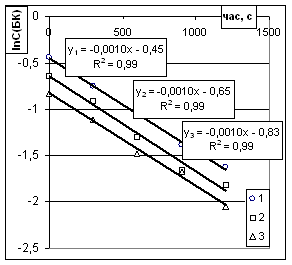
бачимо (рис.1), усі криві лінеаризуються та розміщені паралельно, а константи
швидкостей першої стадії реакції для усіх співвідношень становлять 10*10–4
с–1.
|
|
|
|
Рис.1. Графік залежності lnС(БК) від часу при обробці даних
інтегральним методом для реакції першого порядку. Температура 353К.
Співвідношення іБС/БК 16/1 (1), 20/1 (2), 24/1 (3) |
|
|
|
|
|
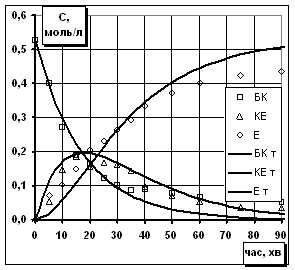
Рис.2. Кінетична модель процесу
естерифікації: експериментальні точки і теоретичні кінетичні криві.
Температура 353К. Співвідношення іБС/БК=20/1 (мол.) |
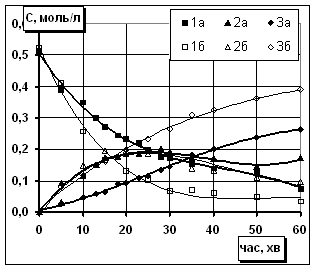
Рис.3.
Кінетичні криві зміни концентрації кислоти (1), моноестеру (2), діестеру (3) з
водою (а) і без води (б). Температура 353К Співвідношення іБС/БК=20/1 (мол.) |
Значення kef2 визначали за умови, що в точці максимального
нагромадження проміжного продукту – моноестеру швидкість його перетворення
дорівнює нулю:
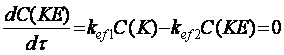 .
.
За розрахованими значеннями ефективних констант швидкостей для
наведеної вище схеми перетворення побудована кінетична модель процесу
естерифікації бурштинової кислоти ізобутиловим спиртом (рис.2). Встановлено, що теоретичні
криві відповідають експериментальним точкам до досягнення конверсії в системі 70-80%,
а надалі спостерігається деяке відхилення, що можна пояснити впливом води, яка
накопичується в результаті реакції та при високому ступені перетворення кислоти
сповільнює процес.
Для підтвердження впливу води було проведено дослідження з її попереднім введенням
у систему. Збільшення концентрації води в реакційному середовищі гальмує
витрату кислоти та нагромадження діестеру, проте на зміну концентрації
моноестеру практично не впливає (рис.3). Очевидно стабільна концентрація
моноестеру при сповільненій витраті кислоти компенсується гідролізом утвореного
діестеру. Тому подальше визначення ефективних констант швидкостей проводили до
досягнення в системі рівноваги. Отже, при менших співвідношеннях та в технологічних
умовах процес доцільно проводити з відгонкою води.
Дослідження естерифікації бурштинової
кислоти бутиловим, аміловим та ізоаміловим спиртами в присутності п-ТСК показали, що за високого надлишку спирту дані
реакції також протікають за законом псевдопершого порядку. Згідно проведених
досліджень при різних температурах та встановлених ефективних констант
швидкостей розраховували графічним методом енергії активації та
передекспоненційні множники реакцій.
Активаційні параметри стадій реакцій
естерифікації бурштинової кислоти
|
Спирт |
Е1, кДж/моль |
k0,1, л2*моль2*с–1 |
Е2, кДж/моль |
k0,2, л2*моль2*с–1 |
|
Ізобутиловий |
60,8 |
1,3*106 |
44,4 |
4,0*103 |
|
Бутиловий |
49,1 |
6,0*104 |
43,2 |
5,8*103 |
|
Ізоаміловий |
51,1 |
5,2*104 |
45,1 |
1,4*104 |
|
Аміловий |
53,9 |
4,8*105 |
26,2 |
3,5*101 |