Физика/1. Теоретическая физика
К.х.н. Фёдоров С.В., д.т.н. Сёмин
Е.Г., академик РАН Данилевич Я.Б.
Санкт-Петербургский государственный
политехнический университет,
Россия
Характерные
особенности расчета изобарной
теплоемкостии энтропии
простых веществ
В основе
расчета термодинамических индивидуальных свойств веществ лежат
термодинамические функции энтропии ![]() , приведенной энергии Гиббса
, приведенной энергии Гиббса ![]() , энтальпии
, энтальпии ![]() , теплоемкости
, теплоемкости ![]() , энергии Гиббса
, энергии Гиббса ![]() , которые могут быть вычислены через статистические суммы по
состояниям молекул (атомов) составляющих
изучаемую термодинамическую систему, а именно
, которые могут быть вычислены через статистические суммы по
состояниям молекул (атомов) составляющих
изучаемую термодинамическую систему, а именно
![]()
![]()
![]()
![]() (1)
где
(1)
где ![]() - сумма по состояниям;
Pi – статистический вес i -го состояния. Согласно статистике
Бозе-Эйнштейна и Ферми-Дирака энтропия веществ не зависимо от агрегатного
состояния, связана с суммой по состояниям
функциями [1]
- сумма по состояниям;
Pi – статистический вес i -го состояния. Согласно статистике
Бозе-Эйнштейна и Ферми-Дирака энтропия веществ не зависимо от агрегатного
состояния, связана с суммой по состояниям
функциями [1]
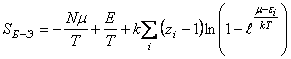 ;
;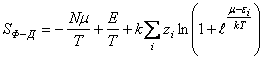 , (2) где
, (2) где ![]() постоянное число частиц системы;
постоянное число частиц системы;![]() постоянная энергия системы;
постоянная энергия системы;
![]() числа заполнения
соответствующих энергетических уровней;
числа заполнения
соответствующих энергетических уровней; ![]() энергия
энергия
i – ой частицы;![]() химический потенциал; k –
постоянная Больцмана;
химический потенциал; k –
постоянная Больцмана;
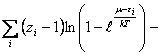 сумма по состояниям.
сумма по состояниям.
Экспериментальное определение
термодинамических функций газов при температурах выше 1000К – задача в
настоящее время практически невыполнимая [2] , поэтому вся информация о выше
приведенных термодинамических функциях:![]() ;
; ![]() ;
; ![]() ;
;![]() ;
;![]() в стандартном состоянии основывается на теоретических расчетах.
Термодинамические функции веществ в конденсированном состоянии, в отличие от
газов, не могут быть вычислены теоретически с достаточной точностью. Несмотря
на то, что с развитием вычислительной техники были сняты ограничения,
обусловленные трудностью расчетов статистических сумм и её производных,
возникли другие проблемы, ограничивающие точность вычисления термодинамических
функций, особенно при высоких температурах. Поэтому термодинамические свойства
многих веществ при этих температурах изучены недостаточно полно, а для ряда
веществ имеющиеся данные либо не надежные, либо совсем неизвестны. Другим недостатком
в использовании статистических принципов расчета термодинамических свойств
веществ является проблема расходимости статистических сумм по состояниям атомов (молекул) веществ. Эта
проблема рассматривалась во многих работах
[3-5], однако до настоящего времени не решена. Основополагающей
термодинамической функцией при изучении процессов теплопередачи является
энтропия. Важнейшей задачей равновесной термодинамики является доказательство
существования энтропии на основе постулатов, отражающих свойства равновесных
термодинамических процессов, которых, как известно, в реальных условиях не
существует, поэтому проблема доказательства существования энтропии привела к
возникновению направления в термодинамике, которое отвергает необходимость
доказательства энтропии с помощью каких либо постулатов. Доказательством
существования энтропии предлагается рассматривать опыт, который подтверждает
все выводы и уравнения, полученные на основе использования аналитического
выражения принципа существования энтропии:
в стандартном состоянии основывается на теоретических расчетах.
Термодинамические функции веществ в конденсированном состоянии, в отличие от
газов, не могут быть вычислены теоретически с достаточной точностью. Несмотря
на то, что с развитием вычислительной техники были сняты ограничения,
обусловленные трудностью расчетов статистических сумм и её производных,
возникли другие проблемы, ограничивающие точность вычисления термодинамических
функций, особенно при высоких температурах. Поэтому термодинамические свойства
многих веществ при этих температурах изучены недостаточно полно, а для ряда
веществ имеющиеся данные либо не надежные, либо совсем неизвестны. Другим недостатком
в использовании статистических принципов расчета термодинамических свойств
веществ является проблема расходимости статистических сумм по состояниям атомов (молекул) веществ. Эта
проблема рассматривалась во многих работах
[3-5], однако до настоящего времени не решена. Основополагающей
термодинамической функцией при изучении процессов теплопередачи является
энтропия. Важнейшей задачей равновесной термодинамики является доказательство
существования энтропии на основе постулатов, отражающих свойства равновесных
термодинамических процессов, которых, как известно, в реальных условиях не
существует, поэтому проблема доказательства существования энтропии привела к
возникновению направления в термодинамике, которое отвергает необходимость
доказательства энтропии с помощью каких либо постулатов. Доказательством
существования энтропии предлагается рассматривать опыт, который подтверждает
все выводы и уравнения, полученные на основе использования аналитического
выражения принципа существования энтропии:
![]() (3)
(3)
В работах [6-9] было предложено
уравнение энтропии и теплоемкости
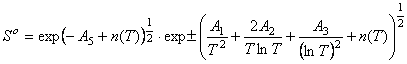 ;
; 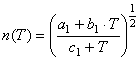 (4)
(4)
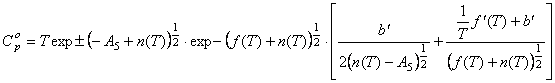 , (5) где
, (5) где 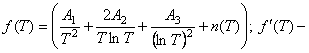 производная от функции
производная от функции ![]() по Т.
по Т.
Если в уравнениях (4), (5) принять ![]() , то они примут вид
, то они примут вид
 ;
;![]() (6)
(6)
 (7)
(7)
В основе расчета
коэффициентов уравнения (6) лежит система равенств
![]() (8)
(8)
В работах [6-9] показано, что функции
(1) однозначно связаны, с найденными из
решения системы уравнений (8),
коэффициентами ![]() . Результаты расчета значений
термодинамических функций по этим уравнениям находятся в хорошем
согласии с литературными источниками [2].
Это значит, что суммы по
состояниям Q(T) в уравнениях (1) и величины
. Результаты расчета значений
термодинамических функций по этим уравнениям находятся в хорошем
согласии с литературными источниками [2].
Это значит, что суммы по
состояниям Q(T) в уравнениях (1) и величины ![]() взаимозависимы. Эта зависимость находится из сопоставления однотипных частей,
вытекающих из преобразований функций (2) и (4)
[6-9] и выражается соотношениями
взаимозависимы. Эта зависимость находится из сопоставления однотипных частей,
вытекающих из преобразований функций (2) и (4)
[6-9] и выражается соотношениями

 (9)
(9)
Из равенств (9) вытекают равенства ![]() ;
;![]() ;
;![]() ;
(10)
;
(10) 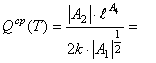
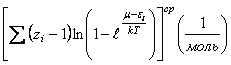 ;
; 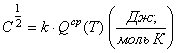 , (11) где
, (11) где ![]() число сумм по
состояниям, связанных с теплоемкостью
число сумм по
состояниям, связанных с теплоемкостью 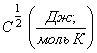 вещества при данной
температуре. Разделив левую и правую части третьего равенства из (11) на полное
число сумм по состояниям
вещества при данной
температуре. Разделив левую и правую части третьего равенства из (11) на полное
число сумм по состояниям ![]() ,
связанных с одним молем вещества при данной температуре и возведя левую и правую
части в квадрат, получим
,
связанных с одним молем вещества при данной температуре и возведя левую и правую
части в квадрат, получим
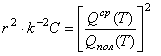 ,
(12) где отношение в квадратных скобках (12) показывает, какая часть сумм по состояниям от их полного
числа при данной температуре связана с изобарной теплоемкостью одного моля вещества;
,
(12) где отношение в квадратных скобках (12) показывает, какая часть сумм по состояниям от их полного
числа при данной температуре связана с изобарной теплоемкостью одного моля вещества; ![]() . Рассмотрим случай,
когда с повышением температуры средняя сумма по состояниям
. Рассмотрим случай,
когда с повышением температуры средняя сумма по состояниям ![]() и при
и при ![]() , а отношение
, а отношение ![]() (13)
(13)
Условию (13)
отвечает равенство
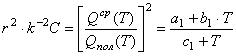 , где
, где ![]() (14)
(14)
или 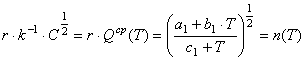 (15) Преобразуем отношение
в квадратных скобках равенства (14)
(15) Преобразуем отношение
в квадратных скобках равенства (14)
![]()
![]() (16)
(16)
Рассматривая правую часть равенства (16) как КПД тепловой
машины, имеем ![]() ,
,
где ![]() количество теплоты, принятое рабочим телом при абсолютной
температуре
количество теплоты, принятое рабочим телом при абсолютной
температуре ![]() ;
;
![]() количество теплоты,
отданное рабочим телом холодильнику при абсолютной температуре
количество теплоты,
отданное рабочим телом холодильнику при абсолютной температуре ![]() . Следовательно, равенство (16) можно рассматривать, как принцип образования энтропии в интегральной форме,
что находится в полном соответствии с принципом существования энтропии в
дифференциальной форме (см.(3)). Надежность уравнений (6) и (7), коэффициенты которых отражены в таблице
1, проверена согласием большого числа
расчетных значений энтропии и изобарной теплоемкости веществ, приведенных в
таблице 2 в сопоставлении с данными литературных источников [2].
. Следовательно, равенство (16) можно рассматривать, как принцип образования энтропии в интегральной форме,
что находится в полном соответствии с принципом существования энтропии в
дифференциальной форме (см.(3)). Надежность уравнений (6) и (7), коэффициенты которых отражены в таблице
1, проверена согласием большого числа
расчетных значений энтропии и изобарной теплоемкости веществ, приведенных в
таблице 2 в сопоставлении с данными литературных источников [2].
Таблица 1
Значения
коэффициентов уравнений (6), (7) для расчета энтропии и изобарной
теплоемкости простых и сложных соединений.
|
№ |
Вещество |
|
|
|
|
|
|
|
|
|
1 |
ZrO2,kp |
268,01 |
36209,56 |
4233,275 |
5,908 |
5,591 |
-31,537 |
-0,27727 |
200-2700 |
|
2 |
Sikp |
68,71 |
2,2024 |
4982,189 |
-68,62 |
4,23 |
-17,04 |
0,8529 |
100-1600 |
|
3 |
Gekp |
606,19 |
57603,21 |
-177,853 |
315,6 |
6,407 |
-42,465 |
-1,4133 |
200-1200 |
|
4 |
Alkp |
132,36 |
38449 |
338,745 |
143,5 |
4,89 |
-26,532 |
-2,684 |
100-500 |
|
5 |
GeO2 |
235,75 |
89786,41 |
2·2161,4 |
-7,61 |
5,463 |
-29,939 |
-0,097 |
300-1300 |
|
6 |
SiOkp |
150,89 |
-195076,2 |
2·5128,52 |
-168,2 |
5,017 |
-22,868 |
2,2974 |
900-2000 |
На базе коэффициентов таблицы 1
произведены расчеты энтропии и изобарных теплоемкостей по уравнениям (6), (7)
ряда веществ, указанных в таблице 1.
Таблица 2
Расчетные значения
энтропии и изобарной теплоемкости веществ по уравнениям (6), (7) в сопоставлении
с данными литературных источников [2].
|
ТК |
|
|
|
|||||||||
|
расч. |
[2] |
расч. |
[2] |
расч. |
[2] |
расч. |
[2] |
расч. |
[2] |
расч. |
[2] |
|
|
Дж/моль К |
||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
100 |
|
|
|
|
3,764 |
3,828 |
|
|
|
|
|
|
|
200 |
29,77 |
30,577 |
|
|
11,78 |
11,66 |
|
|
21,66 |
22,18 |
23,85 |
23,25 |
|
300 |
50,578 |
50,787 |
52,27 |
56,12 |
18,98 |
18,94 |
19,78 |
19,86 |
31,09 |
31,23 |
24,52 |
24,31 |
|
400 |
68,028 |
68,035 |
63,73 |
63,66 |
25,02 |
25,02 |
22,14 |
22,30 |
38,05 |
38,08 |
25,06 |
24,96 |
|
500 |
82,688 |
82,679 |
67,53 |
67,50 |
30,13 |
30,15 |
23,57 |
23,61 |
43,57 |
43,58 |
25,47 |
25,45 |
|
600 |
95,233 |
95,224 |
70,04 |
70,04 |
34,52 |
34,54 |
24,48 |
24,47 |
48,18 |
48,18 |
25,87 |
25,87 |
|
700 |
106,173 |
106,17 |
71,90 |
71,94 |
38,34 |
38,36 |
25,10 |
25,12 |
52,13 |
52,13 |
26,24 |
26,24 |
|
800 |
115,875 |
115,88 |
73,51 |
73,49 |
41,72 |
41,75 |
25,57 |
25,66 |
55,61 |
55,61 |
26,59 |
26,59 |
|
900 |
124,607 |
124,61 |
74,85 |
74,84 |
44,76 |
44,80 |
25,96 |
26,13 |
58,72 |
58,72 |
26,91 |
26,92 |
|
1000 |
132,565 |
132,57 |
76,26 |
76,07 |
47,51 |
47,57 |
26,35 |
26,57 |
61,54 |
61,54 |
27,21 |
27,25 |
|
1100 |
139,9 |
139,87 |
77,72 |
77,21 |
50,05 |
50,13 |
26,79 |
26,97 |
64,12 |
64,12 |
27,49 |
27,57 |
|
1200 |
146,729 |
146,64 |
79,29 |
78,29 |
52,4 |
52,49 |
27,36 |
27,36 |
66,50 |
66,51 |
27,75 |
27,6 |
|
1300 |
153,144 |
152,94 |
81,06 |
79,34 |
54,62 |
54,69 |
28,15 |
27,73 |
|
(ф.п.) |
|
|
|
1400 |
159,221 |
158,86 |
|
|
56,75 |
56,76 |
|
|
|
|
|
|
|
1500 |
|
(ф.п.) |
|
|
58,83 |
58,72 |
|
|
|
|
|
|
|
1600 |
|
|
|
|
60,96 |
60,57 |
|
|
|
|
|
|
|
1700 |
|
|
|
|
|
(ф.п.) |
|
|
|
|
|
|
Другим аргументом в пользу
фундаментального характера
уравнения (4) является совпадение
вытекающего из него параметрического уравнения изобарной теплоемкости, с
конечным результатом преобразований равенства (14) [9]
![]() (17)
(17)
По уравнениям (4), (5), для
кристаллического алюминия в широком интервале температур ![]() ;
; ![]() ;
;![]() приведены расчеты энтропии и изобарной теплоемкости в
сопоставлении с данными литературных источников [2] в таблицах 3,4 [7-9]
приведены расчеты энтропии и изобарной теплоемкости в
сопоставлении с данными литературных источников [2] в таблицах 3,4 [7-9]
Таблица 3
Расчетные значения энтропии и
изобарной теплоемкости кристаллического алюминия по уравнениям (4) и (5) в сопоставлении с
данными [2].
|
TK |
|
|
||||
|
n(T) |
расч. |
[2] |
n(T) |
расч. |
[2] |
|
|
Дж/моль |
|
Дж/моль |
||||
|
100 |
-2,736 |
6,98 |
6,945 |
|
|
|
|
200 |
-2,71 |
19,317 |
19,179 |
-2,83 |
22,732 |
21,59 |
|
300 |
-2,683 |
28,47 |
28,34 |
-2,5 |
24,206 |
24,384 |
|
400 |
-2,657 |
35,62 |
35,692 |
-2,316 |
25,226 |
25,665 |
|
500 |
-2,63 |
41,547 |
41,547 |
-2,2 |
26,472 |
26,759 |
|
600 |
-2,604 |
46,65 |
46,531 |
-2,116 |
27,907 |
27,973 |
|
700 |
-2,5771 |
51,146 |
50,948 |
-2,055 |
29,628 |
29,415 |
|
800 |
-2,5505 |
55,16 |
54,984 |
-2,008 |
31,698 |
31,576 |
|
933 |
-2,5152 |
59,908 |
59,992 |
-1,956 |
34,473 |
33,881 |
Таблица 4.
Значения изобарной теплоемкости
твердой фазы алюминия, рассчитанные по уравнению (5) в интервалах температур ![]() и
и ![]()
|
|
|
|||||||||
|
|
|
|||||||||
|
TK |
|
расчет |
[2] |
Отн. ош % |
TK |
|
расчет |
[2] |
Отн.ош % |
|
|
Дж/моль К |
|
Дж/моль К |
|
|||||||
|
55 |
-8,83 |
6,206 |
- |
- |
100 |
-2,3 |
13,04 |
13,05 |
0 |
|
|
60 |
-3,7 |
6,457 |
- |
- |
130 |
-2,258 |
16,5 |
- |
- |
|
|
80 |
-2,5 |
10,23 |
10,14 |
0 |
150 |
-2,53 |
18,21 |
18,21 |
0 |
|
|
90 |
-2,375 |
11,78 |
- |
- |
180 |
-2,61 |
20,32 |
- |
- |
|
|
100 |
-2,3 |
13,07 |
13,05 |
0 |
200 |
-2,65 |
21,57 |
21,59 |
0 |
|
ВЫВОДЫ
1. Рассмотрена возможность внутренней
согласованности уравнений энтропии Бозе-Эйнштейна (1), и Ферми-Дирака (2), с
предложенным уравнением энтропии (8), из
которых вытекает система равенств (16)-(28), на базе которых
установили связь постоянных ![]() уравнения (8) с энергетическими и статистическими параметрами уравнений (1) и (2).
уравнения (8) с энергетическими и статистическими параметрами уравнений (1) и (2).
2. Фундаментальный характер уравнения
(8) основан не только на результатах расчета молярных энтропий и изобарной
теплоемкости простых и сложных соединений и хорошей сходимостью с данными
литературных источников [2,], но и на соблюдении основополагающего, фундаментального
соотношения ![]() (см.т.2)
(см.т.2)
3. Установлено параметрическое уравнение
(17) и показана согласно результатам расчета изобарной теплоемкости их хорошая сходимость с данными литературных
источников [2,6].
ЛИТЕРАТУРА
1. В.К. Семенченко.
Избранные главы теоретической физики. Изд. «Просвещение» М. 1966.
2. В.П. Глушко, Л.В. Гуревич, Г.А. Бергман и др.
Термодинамические свойства индивидуальных веществ. «Наука». – М. 1978. – т. I-IV.
3.
Ларкин А.И – Журнал Экспериментальной и теоретической физики. 1960, 36,
1896
4. Fermi E. – “ Z. Phys” , 1924,26,54.
5. Planck M. – “Ann. Physiс”, 1924, 75, 673.
6. С.В. Федоров. Характерные особенности
расчета изобарной теплоемкости и
энтропии простых веществ. СПб ГПУ. Материалы XII Международной конференции. – 2005. –
т.I. – c. 294-299 .
7. C.В. Федоров Уравнение теплового
баланса и новые принципы расчета изобарной теплоемкости простых веществ. СПб
ГПУ. Материалы XII Международной конференции, т. I.. – 2005. – c. 290-294 .
8. С.В. Федоров. Энтропия и изобарная
теплоемкость простых и сложных веществ. СПб ГПУ. Материалы XI Всероссийской конференции «Фундаментальные
исследования и инновации в технических университетах». – 2007. – с. 497-506.
9. С.В. Федоров. Новые принципы
расчета функций образования термодинамических
свойств веществ. СПб ГПУ. Материалы XV Международной научно-методической
конференции «Высокие интеллектуальные технологии и инновации в образовании и науке».
– 2008. – с. 303-329.