Химия и химические технологии / 5. Фундаментальные проблемы создания новых материалов и технологий
К.х.н. Мальцева В.С., д.х.н. Ниязи Ф.Ф., аспирант
Сазонова А.В.
Юго-Западный государственный университет, Курск, Россия
СОРБЦИОННОЕ КОНЦЕНТРИРОВАНИЕ
КАТИОННЫХ КРАСИТЕЛЕЙ НА ПРИРОДНОМ КАРБОНАТЕ
Среди экологических проблем, связанных с
предотвращением загрязнения окружающей среды, важное место занимает разработка
эффективных методов очистки сточных вод от токсичных загрязнителей, к которым
относятся органические вещества (ПДК = 10-5 г/л) [1].
Целью данной работы является изучение
термодинамических характеристик процесса сорбции органических красителей на
природных карбонатах в качестве научного обоснования использования данных
сорбентов для очистки сточных вод текстильных предприятий.
Опыты по очистке сточных вод от
промышленных красителей проводили, используя модельные водные растворы и
сточные воды красильно-отделочного цеха трикотажного объединения «Сейм» (г.
Курск). Для приготовления модельных водных растворов использовали промышленные
красители - катионный синий и катионный красный квалификации «ч.д.а.» без
дополнительной очистки.
В качестве сорбента использовали природные
карбонаты Курской области (Конышовский (с. Беляево) с размером частиц 0,06-2,0
мм.
Для фотометрического определения
промышленных красителей находили максимум светопоглощения данного красителя.
Для этого сняты спектры поглощения красителей в координатах: оптическая
плотность (А) - длина волны (λ) на приборе СФ-26, выбраны длины волн
максимального светопоглощения для катионного синего 2К - 610 нм, катионного
красного 5Ж - 490 нм.
Для установления
зависимости между оптической плотностью и концентрацией определяемых веществ
использовали прием последовательного разбавления исходного раствора
дистиллированной водой. Затем снимали оптическую плотность растворов
органических красителей относительно раствора сравнения - дистиллированной
воды, переходя от меньших концентраций к большим.
В работе использован метод одноступенчатой
статической сорбции.
Выбор данного направления
связан с актуальностью поиска эффективных сорбентов для очистки воды от
растворимых примесей. Наличие в Курской области месторождений карбонатных
минералов значительно повышает актуальность данной работы. При этом доступность
месторождений и относительно невысокая стоимость минералов придает полученным
результатам практическую значимость. Изучение состава, структуры и ряда других
свойств карбонатных пород показало, что образцы имеют относительно развитую
поверхность и не содержат канцерогенных примесей токсичных веществ,
препятствующих применению минералов в качестве сорбентов при очистке сточных
вод.
Исследование карбонатных пород
Курской области Конышовского района
показало, что по физико-химическим признакам и составу они относятся к
мелоподобным мергелям (CaCO3 - от 45,95 до 49,5 %; Аl2O3 и Fe2O3 - от 1,53 до 1,84%; SiO2 -
от 9,85 до 11,2%) и имеет характерный светло серый цвет.
Опыты необходимые для построения изотерм
сорбции проводили, помещая в серию растворов с различными начальными
концентрациями (С, мкмоль/л) навески сорбента одинаковой массы. Заливали их
одинаковыми объёмами водных растворов исследуемых веществ. Растворы
перемешивали с помощью магнитной мешалки до установления состояния равновесия.
Затем раствор отделяли от сорбента фильтрованием через бумажный фильтр «синяя
лента» и определяли в нем остаточную концентрацию исследуемых веществ.
Изучение
сорбции промышленных катионных красителей проводили при следующем соотношении
фаз: время t=30 мин, объём V=50 мл, исходная
концентрация С0=0,01 г/л, масса сорбента m=0,5 г.
Основные сведения о сорбционных свойствах
материала и характере адсорбции на нем определяемых веществ могут быть получены
из изотерм сорбции, характеризующих зависимость сорбционных свойств (Г) от
концентрации (С) сорбируемого компонента при постоянной температуре: Г=f(С).
Сорбцию (Г, мкмоль/л) органических красителей рассчитывали по формуле:
![]() ,
(1)
,
(1)
где С - исходная концентрация, мкмоль/л; СОСТ
- равновесная (остаточная) концентрация, ммоль/л; m - масса навески сорбента, г; V - объём раствора, л.
Во всех
экспериментах каждое значение величины сорбции является средним арифметическим
из результата не менее трех измерений. Средняя погрешность определения величины
сорбции (А) составляет ± 0,005 ммоль/г.
Погрешность эксперимента не превышала 10%.
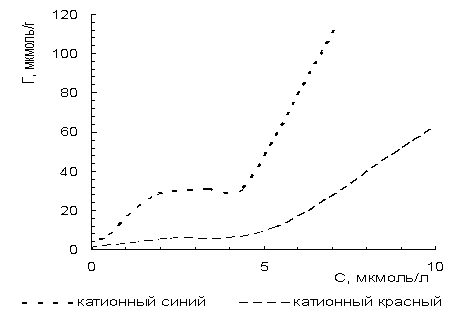
Рисунок
1 – Изотермы сорбции катионных красителей на природном карбонате
По классификации, данной Брунауэром,
Эмметом и Теллером, изотермы, характеризующие процесс адсорбции промышленных
катионных красителей на природном
карбонате, больше напоминают изотерму IV типа.
По форме изотермы можно сделать предположение о механизме процесса сорбции [3].
Данные S-образные изотермы относится к изотермам
переходно-пористого сорбента. Выпуклые участки изотермы сорбции указывают на
наличие в сорбентах микропор, но, кроме того, имеют еще и макропоры, на которые
указывают вогнутые участки. Чем круче изотерма, тем мельче микропоры. Нижняя
часть S-образной кривой от начала координат до точки перегиба
соответствует образованию мономолекулярного слоя, а затем происходит
полимолекулярная адсорбция, объясняющая дальнейший подъем кривой.
Для математического описания статического
равновесия, устанавливающегося в процессе сорбции, существуют различные модели
происходящих процессов. Однако следует отметить, что трудно найти
математическое уравнение, удовлетворительно описывающее изотерму при всех
значениях степени заполнения поверхности сорбента. Это связано с тем, что при
рассмотрении широкой области концентраций сорбата может изменяться как его
состояние в растворе, так и свойства поверхности сорбента.
Изотерма сорбции Ленгмюра является одной
из важных теоретических функций. Ленгмюровская модель сорбции из растворов
предполагает, что на поверхности имеется определенное число центров сорбции,
обладающих одинаковой энергией сорбции [2]. Все сорбированные частицы
взаимодействуют только с центрами сорбции и не взаимодействуют друг с другом,
поэтому на поверхности сорбента образуется мономолекулярный сорбционный слой.
Модель Ленгмюра довольно проста и имеет достаточно общий характер. Она служит
отправной точкой при построении других точных моделей.
Для определения значений констант,
входящих в уравнения изотерм Ленгмюра, использовали аппроксимацию методом
наименьших квадратов.
Уравнение Ленгмюра описывает изотерму
адсорбции во всех областях равновесных концентраций. На практике для
аналитического описания изотермы мономолекулярной адсорбции чаще всего
используют линейную форму уравнения Ленгмюра:
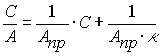 (2)
(2)
где ![]() - удельная
адсорбция, ммоль/г; Апр -
предельная адсорбция, мкмоль/г; С - равновесная концентрация сорбата, мкмоль/л;
- удельная
адсорбция, ммоль/г; Апр -
предельная адсорбция, мкмоль/г; С - равновесная концентрация сорбата, мкмоль/л;
![]() –
адсорбционная константа.
–
адсорбционная константа.
Это выражение
позволяет графическим способом найти константы в уравнении Ленгмюра. По
экспериментальным данным строим график С/А=f(С) и проводим линейную аппроксимацию методом
наименьших квадратов. Полученная зависимость представлена на рисунке 2.
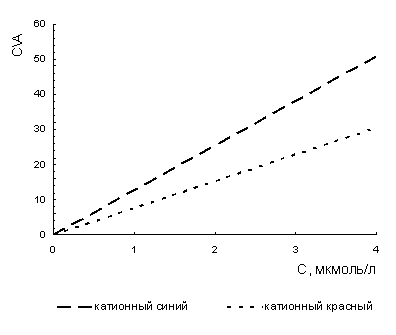
Рисунок 2 - Линейная зависимость уравнения
Ленгмюра после сорбции катионных красителей на поверхности природного
карбоната.
Линейная зависимость уравнения Ленгмюра
после сорбции катионных красителей на поверхности природного карбоната
представляет собой уравнение прямой. По тангенсу угла наклона прямой находим
величину предельной адсорбции (Апр=ctgα) и адсорбционную константу (k).
Предельная сорбция (сорбционная емкость)
природных карбонатов обуславливает взаимодействие между функциональными
группами органических красителей и сорбентом, которое определяют селективные
свойства сорбента. Сорбционная емкость для красителя катионного синего (Апр=1,53986
мкмоль/г) больше, чем для красителя катионного красного (Апр=1,32705
мкмоль/г).
Рассчитанный из уравнения Ленгмюра
параметр k, характеризует энергию
сорбционного процесса. Для катионного синего красителя k=11,20774, для катионного красного красителя k=0,52741. Таким образом, устойчивость комплексов
образующихся между функциональными группами катионным синим красителем и
природным карбонатом больше, чем для катионного красного.
Поскольку при сорбции
вещества из воды происходит уменьшение свободной энергии системы ∆G, Когановский предложил использовать эту величину для
прогнозирования эффективности извлечения растворённых соединений из воды.
Константа равновесия при сорбции из растворов k связана с ∆G зависимостью
вида:
∆G=-RTlnk, (3)
где R - газовая постоянная, равна 8,314 Дж/моль·К; T -
температура реакции, К.
Энергия Гиббса по уравнению Ленгмюра для
катионного синего красителя составляет
∆G= -2600,256 Дж/моль, для катионного красного красителя
∆G= -688,401 Дж/моль, что свидетельствует о лучшей
сорбционной способности катионного синего красителя. Отрицательное значение
энергии определяет самопроизвольность протекания процесса извлечения.
Список литературы
1.
Богдановский, Г.А. Химическая экологи. - М.: 1995, 435 с.
2.
Солдаткина, Л.М., Сагайдак, Е.В. Кинетика адсорбции водорастворимых красителей
на активных углях // Химия и технология воды, 2010. т. 32. №4. - с. 388-398
3. Сазонова,
А.В., Ниязи, Ф.Ф., Мальцева, В.С. Термодинамика и кинетика сорбции ионов хрома (III) карбонатными породами // «Современные проблемы науки и образования», г. Москва,
№1, 2012 / http://www.science-education.ru