Химия
и химические технологии/5. Фундаментальные проблемы создания новых материалов и
технологий
Шамина
О.А., Кузнецова Д.К., к.х.н. Шачнева Е.Ю., д.х.н. Алыков Н.М.
Астраханский государственный университет, Россия
ИССЛЕДОВАНИЕ АДСОРБЦИИ АМИКАЦИНА ИЗ ВОДНЫХ
РАСТВОРОВ АКТИВНЫМ УГЛЕМ
Целью
работы явилось изучение адсорбции амикацина на активном угле. Получены изотермы
статической сорбции веществ из водных растворов, рассчитаны основные термодинамические
характеристики сорбции, рассмотрена кинетика сорбции амикацина [1-3].
Получение данных для построения градуировочного графика. В серию из 10
пробирок объемом 10 см3 вносили 0; 0,05; 0,1; 0,2; 0,3; 0,4; 0,5;
0,6; 0,7; 0,8 см3 раствора амикацина с концентрацией 1·10-3 М,
к раствору прибавляли по 2 см3 раствора эриохрома черного и доводили объемы растворов до 10 см3
pH 3,
перемешивали и давали отстояться 1час. Далее растворы центрифугировали 10 мин
при 1500 об./мин, после сливали раствор ценрифугата, оставляя образовавшиеся
осадки на дне пробирок. Затем осадок растворяли 10-2 М раствором NaOH, перемешивали и измеряли оптические плотности растворов при длине волны 560 нм в
кювете на 0,1 см относительно воды. По результатам измерений строили градуировочный
график.
Изучение
адсорбции амикацина на активном угле. В серию из 10 пробирок объемом 10
см3 вносили 0; 0,05; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8 см3
раствора амикацина с концентрацией 10-3 М, доводили объем растворов
до 8 см3 буферным раствором pH 3. В полученный
раствор вносили по 0,2 г сорбента, встряхивали 3 мин, отстаивали, центрифугировали
при 1500 об./мин. Сливали 2 см3 полученного раствора в пробирки,
добавляли 2 см3 органического реагента эриохрома черного и 6 см3
раствора 10-2 М гидроксида натрия. Полученные растворы
перемешивали и измеряли оптические плотности растворов при 560 нм в кювете
толщиной 0,1 см относительно воды. Опыты проводили при 277, 298, 310 К. Строили
графические зависимости оптической плотности от концентрации амикацина.
По градуировочному графику, с использованием
результатов опытов, определяли равновесные концентрации исследуемых веществ.
Строили изотермы сорбции в координатах «сорбция (Г) - равновесная
концентрация [c]». Сорбцию
(Г) рассчитывали по уравнению (1):
![]() (1)
(1)
где С0 – исходная концентрация сорбата,
моль/дм3; V – объем
исследуемого раствора, см3; [С]
– остаточная (равновесная) концентрация сорбата, моль/дм3; M – молярная (или атомная) масса сорбата, г/моль; m – масса угля, г.
Изотермы сорбции были перерассчитаны в изотермы
уравнения Ленгмюра в прямолинейной форме, а с их использованием были рассчитаны
константы сорбции (К) и величины предельной сорбции (Г∞) при
277, 298 и 310 К.
По величинам констант сорбции были рассчитаны
изменение энтальпии (DН) и
изобарно-изотермического потенциала (DG), а с их
использованием были рассчитаны значения изменения энтропии (DS) (2-4):
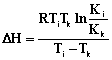 (2)
(2)
![]() (3)
(3)
![]() (4)
(4)
Результаты
опытов и расчетов приведены в табл.1.
Таблица 1
Основные
характеристики сорбции амикацина на активном угле
(n = 6, Р = 0,95, tp = 2,57)
|
Определяемая
характеристика |
Температура,
К |
Активный
уголь |
|
Константы
сорбции · 10-3 |
277 |
8,71 |
|
298 |
12,34 |
|
|
313 |
19,90 |
|
|
-ΔG, кДж/моль |
277 |
20,89 |
|
298 |
23,34 |
|
|
313 |
25,46 |
|
|
-ΔH, кДж/моль |
1,45 |
|
|
ΔS, Дж·моль/К |
277 |
70,20 |
|
298 |
73,46 |
|
|
313 |
77,45 |
|
|
Емкость
сорбента (Г∞), мг/г |
277 |
6,66 |
|
298 |
10,00 |
|
|
313 |
17,28 |
|
Анализ полученных результатов позволяет сделать заключение о том, что сорбция амикацина на активном угле идет достаточно активно. Отрицательные значения энтальпии и изобарно-изотермического потенциала свидетельствуют о самопроизвольном характере процесса сорбции. Полученные результаты позволяют считать, что происходит образование прочных адсорбционных комплексов, при этом емкость угля по отношению к препарату достаточно высока.
Изучение кинетики адсорбции амикацина на активном угле.
В колбу с раствором с определенной концентрацией амикацина (1·10-3
М) вносили 2 г мелкораздробленного сорбента, одновременно включали секундомер и
быстро перемешивали. Отбирали в пробирку 10 см3 этого раствора.
Полученные растворы исследовали при температурах 298, 277 и 313 К. Через
определенные промежутки времени отбирали пробы мутного раствора, отфильтровывали
через стеклянный фильтр и центрифугировали их. Отбор проб проводили через
определенные промежутки времени до 40 мин. Из центрифужных пробирок каждой
пробы отобрали пробу раствора по 2 см3 и вносили их в чистые
пробирки, добавляли 2 см3 реагента эриохрома черного и доводили
объем пробирок до 10 см3 10-2М NaOH. Перемешивали и измеряли оптическую плотность при 560 нм в
кювете на 0,1 см
относительно воды. По величинам оптических плотностей были построены изотермы
кинетики сорбции в координатах «оптическая плотность (А) – время (τ)». По результатам исследований были рассчитаны константы
кинетики сорбции, S# и
Еакт раствора амикацина на активном угле при температурах 277,
298 и 313 К:
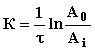 , (5)
, (5)
где А0
– исходная оптическая плотность; Аi – оптическая
плотность в момент времени τ; τ – время, с.
По графикам Аррениуса в координатах
«lnK – 1/T» рассчитаны величины энергии активации кинетики сорбции (Еакт), а также с
использованием уравнения Эйринга изменение энтропии образования сорбционных
комплексов (S#):
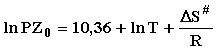 (6)
(6)
В уравнении (6) PZ0 – предэкспоненциальный фактор в уравнении Аррениуса, ∆S# - изменение энтропии активации формирования активированного
комплекса, R – газовая постоянная, Т
- температура.
Результаты расчетов констант кинетики сорбции, Еакт и ∆S# амикацина на активном угле
приведены в табл.2.
Таблица 2
Термодинамические
характеристики кинетики сорбции амикацина
на активном угле (n=6,
Р=0,95, tp=2,57)
|
Определяемая характеристика |
Температура, К |
Активный уголь |
|
Константы скоростей К×10-2 с-1 при температурах, К |
277 |
0,16 |
|
298 |
0,24 |
|
|
313 |
0,37 |
|
|
Еакт, кДж/моль |
В пределах от 277 до 313 К |
1,6 |
|
-DS#, Дж/моль×К |
277 |
1,72 |
|
298 |
1,73 |
|
|
313 |
1,74 |
Практически
для всех изученных сорбционных процессов характерен достаточно крутой начальный
участок изотерм кинетики сорбции. Как видно из результатов опытов, сорбция
протекает достаточно быстро, и заканчивается в течение минуты, что позволяет
сделать вывод о том, что сорбат практически полностью сорбируется на активном
угле.
Литература
1.
Машковский М.Д.
Лекарственные средства // М.: ООО «Издат. Новая Волна». – 2002. – В 2 т. Т. 1.
– 540 с. – 8 с. – ил.
2.
Шачнева Е.Ю., Алыков
Н.М., Кузнецова Д.К., Шамина О.А. Влияние аминогликозидных препаратов на
здоровье человека // «Научное творчество XXI века»: VI Межд. научн.-практ. конф. – Красноярск. – 2012. –
С.375-380.
3.
Арзамасцев А.П.
Фармацевтическая химия // М.: Изд. «РАМН». – 2004. -662 с.