Химия и химические технологии/8. Кинетика и катализ
К.х.н. Рахматуллин Р.Р.
Казанский национальный
исследовательский технологический университет,
Россия
Кинетика реакции
арсенита натрия с бромистым бутилом
Реакция
Мейера является основным методом получения алкиларсоновых кислот и заключается
во взаимодействии арсенитов щелочных металлов с галогенпроизводными [1].
В
настоящей работе исследована кинетика реакции Мейера на примере взаимодействия
арсенита натрия с бромистым бутилом.
Взаимодействие арсенита натрия с бромистым
бутилом в водно-щелочной среде описывается следующими реакциями:
![]() Na3AsO3 + BuBr
k м (NaO)2As(O)Bu + NaBr
Na3AsO3 + BuBr
k м (NaO)2As(O)Bu + NaBr
I II x
![]() BuBr + NaOH k г BuOH + NaBr
BuBr + NaOH k г BuOH + NaBr
Кинетические исследования
проводились при 70![]() , интенсивном перемешивании и избытке бромистого бутила, значительно превышающем его
растворимость в водно-щелочной среде. В связи с этим концентрация бромистого
бутила в реакционной массе определялась его растворимостью в водно-щелочной
среде и в проводимых кинетических исследованиях являлась величиной постоянной.
, интенсивном перемешивании и избытке бромистого бутила, значительно превышающем его
растворимость в водно-щелочной среде. В связи с этим концентрация бромистого
бутила в реакционной массе определялась его растворимостью в водно-щелочной
среде и в проводимых кинетических исследованиях являлась величиной постоянной.
Исходя из
предположения о том, что взаимодействие
арсенита натрия с бромистым бутилом протекает по SN2 механизму, скорость реакции Мейера (W) должна
описываться уравнением второго порядка (1).
W = kм• cI
• cII (1)
Здесь:
kм – константа скорости взаимодействия арсенита натрия с
бромистым бутилом .
cI, cII – текущие
концентрации арсенита натрия и бромистого бутила соответственно.
В водно-щелочной
среде бромистый бутил подвергается гидролизу, однако, в принятых условиях
постоянно обеспечивалось равновесие в системе бромистый бутил – вода и при
изучении кинетики можно было не
учитывать расход бромистого бутила в параллельно протекающей реакции его
щелочного гидролиза. Так как, концентрация бромистого бутила в изучаемых
условиях является величиной постоянной, то уравнение (1) принимает следующий
вид:
W
= kэф. • cI, где kэф. = kм • cII
Контроль за ходом реакции осуществлялся
по скорости расходования арсенит-иона иодометрическим титрованием.
Значения константы скорости kэф. взаимодействия
арсенита натрия с бромистым бутилом определялись по уравнению (2) первого
порядка [2] и приведены в табл. 1.
kэф. = 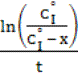 (2)
(2)
Здесь:
![]() - начальная
концентрация арсенита натрия, моль/л
- начальная
концентрация арсенита натрия, моль/л
x – текущая концентрация
натриевой соли бутиларсоновой кислоты, моль/л
t –
время реакции, c.
Таблица 1
Кинетика
взаимодействия арсенита натрия с бромистым бутилом в водно-щелочной среде при
70![]()
![]() = 0,1308 моль/л,
= 0,1308 моль/л, ![]() = 1,600 моль/л
= 1,600 моль/л
|
Время
реакции, c•102 |
cI,
моль/л |
Конверсия,% |
kэф.• 105,
c-1 |
|
36 |
0.1245 |
4.82 |
1.371 |
|
54 |
0.1213 |
7.26 |
1.396 |
|
72 |
0.1177 |
10.0 |
1.466 |
|
90 |
0.1147 |
12.3 |
1.459 |
|
108 |
0.1113 |
14.9 |
1.495 |
|
126 |
0.1087 |
16.9 |
1.469 |
|
144 |
0.1058 |
19.1 |
1.473 |
|
162 |
0.1025 |
21.6 |
1.535 |
|
180 |
0.1000 |
23.5 |
1.492 |
|
198 |
0.09824 |
24.9 |
1.448 |
|
216 |
0.09576 |
26.8 |
1.442 |
Примечание.
а) среднее значение kэф.=1.459 • 10-5
с-1.
Как видно из
приведенных данных (табл. 1), в ходе кинетической кривой значения константы
скорости kэф. являются
величинами практически постоянными. Постоянство величины kэф. наблюдается и в серии опытов с различными начальными
концентрациями арсенит-иона (табл. 2).
Таблица 2
Константы скорости взаимодействия арсенита
натрия с бромистым бутилом в водно-щелочной среде при 70![]()
|
|
|
t•10-2,
c |
Конверсия,% |
kэф.• 105,
c-1 |
|
0.08874 |
1.600 |
198 |
26.2 |
1.389± |
|
0.1308 |
1.600 |
216 |
26.8 |
1.459± |
|
0.1320 |
1.199 |
216 |
22.7 |
1.203± |
|
0.1313 |
2.000 |
216 |
26.5 |
1.626± |
|
0.1767 |
1.600 |
216 |
24.9 |
1.342± |
|
0.2006 |
1.799 |
216 |
23.6 |
1.466± |
|
0.2024 |
1.799 |
216 |
24.4 |
1.382± |
Примечание. Среднее
значение kэф.=1.410 •10-5c-1.
С целью
подтверждения рассматриваемого механизма реакции был определен порядок реакции
взаимодействия арсенита натрия с бромистым бутилом. Порядок реакции определялся
дифференциальным методом [3], основанном на измерении скорости в начальной
момент времени по углу наклона касательной к кинетической кривой. Так как, все
опыты проводились при постоянной концентрации бромистого бутила (табл. 2), то
порядок реакции определялся только по арсениту натрия и оказался равным n=0,983![]() 1.
1.
В аналогичных
условиях была изучена кинетика щелочного гидролиза бромистого бутила. Контроль
за ходом реакции осуществлялся аргентометрическим титрованием образующегося
бромид-иона. Бромистый бутил брался в избытке. В виду того, что реакция
протекает при избытке бромистого бутила концентрацию бромистого бутила можно
считать постоянной. Расчет константы скорости щелочного гидролиза бромистого
бутила осуществлялся по уравнению первого порядка. Среднее значение константы
скорости щелочного гидролиза бромистого бутила определенное из двух
параллельных опытов составило kг = 0.6692![]() 10-5c-1.
10-5c-1.
Сравнение величин kэф. и kг позволяет сделать
вывод о том, что арсенит ион ![]() обладает более
высокой нуклеофильной способностью, чем гидроксил-ион. Отношение kэф./kг
обладает более
высокой нуклеофильной способностью, чем гидроксил-ион. Отношение kэф./kг![]() 2.11.
2.11.
С целью
определения величины константы скорости kм исследована
кинетика взаимодействия арсенита натрия c
бромистым бутилом в спирто-водной щелочной среде. Предельная растворимость
бромистого бутила определялась в водных смесях с этанолом и пропанолом-2.
Результаты приведены в табл. 3.
Таблица 3
Предельная растворимость бромистого бутила в водных спиртах
при 25 ![]()
|
Растворитель
спирт : вода, %, об. |
cII,
моль/л |
|
20% (этанол) :
80% |
малорастворим |
|
40% (этанол) :
60% |
малорастворим |
|
70% (этанол) :
30% |
0.780 |
|
70% (пропанол-2)
: 30% |
0.435 |
В 70%-ном водном
этаноле бромистый бутил растворяется достаточно хорошо и в этих условиях все
компоненты реакции находятся в растворенном состоянии. При изучении кинетики, в
данном случае, необходимо учитывать побочную реакцию – щелочной гидролиз
бромистого бутила. Общая скорость процесса описывается уравнением (3).
W = kмcIcII + kгcIIcNaOH (3)
Где
W – скорость накопления бромид-иона,
kм – константа
скорости взаимодействия арсенита натрия с бромистым бутилом,
kг – константа
скорости щелочного гидролиза бромистого бутила.
Для расчета kм по уравнению (3)
необходимо определить константу cкорости щелочного
гидролиза бромистого бутила kг. Щелочной гидролиз
бромистого бутила изучался в 70%-ном водном этаноле при 70![]() . Контроль за реакцией осуществлялся аргентометрическим
титрованием бромид-иона. Величины константы скорости щелочного гидролиза
рассчитывались по уравнению (4) второго порядка [2] и приведены в табл. 4.
. Контроль за реакцией осуществлялся аргентометрическим
титрованием бромид-иона. Величины константы скорости щелочного гидролиза
рассчитывались по уравнению (4) второго порядка [2] и приведены в табл. 4.
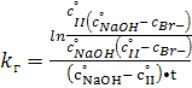 (4)
(4)
Таблица 4
Кинетика щелочного гидролиза бромистого бутила в 70%-ном водном этаноле
при 70![]()
![]() = 0.4443
моль/л,
= 0.4443
моль/л, ![]() = 0.4016 моль/л
= 0.4016 моль/л
|
Время реакции, c•102 |
сBr-,
моль/л |
Конверсия, % |
kг•104,
л/(моль•с) |
|
18 |
0.1144 |
25.8 |
4.888 |
|
36 |
0.1678 |
37.8 |
4.339 |
|
54 |
0.1939 |
43.6 |
3.626 |
|
72 |
0.2110 |
49.7 |
3.616 |
|
90 |
0.2425 |
54.6 |
3.557 |
|
108 |
0.2561 |
57.7 |
3.589 |
|
126 |
0.2693 |
60.6 |
3.570 |
|
144 |
0.2756 |
62.0 |
3.610 |
|
162 |
0.2876 |
64.4 |
3.567 |
|
180 |
0.2922 |
65.8 |
3.520 |
Примечание. а) Среднее значение kг=3.598 •10-4
л/моль•с
Среднее значение константы
скорости щелочного гидролиза бромистого бутила в 70%-ном водном этаноле
определенное из трех параллельно проведенных экспериментов равно kг ср. = 3.570•10-4
л/(моль•с).
При изучении кинетики взаимодействия арсенита натрия с бромистым бутилом
в спирто-водной щелочной среде содержащей 70% об. этанола контроль за ходом
процесса осуществлялся аргентометрическим титрованием образующегося
бромид-иона. В начальный момент времени скорость процесса описывается
кинетическим уравнением (5)
W = kм![]() + kг
+ kг![]() (5)
(5)
Константа скорости арсенита натрия с бромистым бутилом рассчитывалась по
уравнению (6) в начальной момент времени.
kм 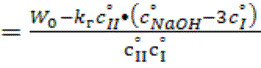 (6)
(6)
Скорость реакции в начальный момент времени (W0) определялась по методу касательных [3] к кинетической
кривой в координатах cBr-=f(t) в
нулевой момент времени. Для расчета kм использовалась
ранее определенная константа скорости щелочного гидролиза бромистого бутила в
70%-ном водном этаноле kг=3.570•10-4 л/(моль•с).
Константы скорости реакции Мейера kм рассчитанные по
уравнению 6 приведены в табл. 5.
Таблица
5
Константы скорости взаимодействия арсенита натрия с бромистым бутилом в
спирто-водной щелочной среде, содержащей 70% об. этанола при 70![]()
|
|
|
|
kм•104,
л/(моль•с) |
|
0.1317 |
0.4670 |
0.8032 |
4.46 |
|
0.1279 |
0.1907 |
0.8032 |
4.51 |
|
0.1327 |
0.2667 |
0.8032 |
4.22 |
|
0.0252 |
0.4443 |
0.5001 |
4.64 |
Примечание. а) Среднее значение kм=4.413•10-4
л/(моль•с).
Константы скорости взаимодействия арсенита натрия с бромистым бутилом и
щелочного гидролиза бромистого бутила в 70%-ном водном этаноле по своим
значениям сопоставимы и соответственно составляют kм=4.413•10-4
л/(моль•с) и kг=3.590•10-4
л/(моль•с). Соотношение kм/kг=1.24.
Кинетические уравнения для расчета констант скорости как в
водно-щелочной, так в и в спирто-водной щелочной средах выведены из
предположения о том, что взаимодействие арсенита натрия с бромистым бутилом
протекает по бимолекулярному механизму.
Постоянство значений констант скорости Мейера kэф. (табл. 1,2) в водно-щелочной и kм (табл. 5) в
спирто-водной щелочной средах подтверждает, что взаимодействие арсенита натрия
с бромистым бутилом протекает по SN2
механизму, где в качестве нуклеофила выступает арсенит-ион.
![]()
![]()
![]()
![]() -O -O H
H
-O -O H
H
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() -O
-O ![]() + CH3CH2CH2CH2Br -O As ••• C ••• Br
+ CH3CH2CH2CH2Br -O As ••• C ••• Br ![]() -O -O (CH2)2
-O -O (CH2)2
CH3
![]()
![]() O
O
![]()
![]()
![]()
![]() - -O As (CH2)3CH3 + Br-
- -O As (CH2)3CH3 + Br-
-O
Взаимодействие арсенита натрия с бромистым бутилом представляет собой
нуклеофильное замещение, протекающее между анионом и нейтральной молекулой.
Арсенит-ион за счет неподеленной пары атома мышьяка атакует частично
положительно заряженный α-углеродный
атом бромистого бутила, при этом в переходном состоянии происходит
рассредоточение заряда и передача отрицательного заряда с одного из атомов
кислорода арсенит-иона к атому брома.
В результате реакции Мейера происходит образование новой связи
мышьяк-углерод, двойной связи мышьяк-кислород и изменяется валентность мышьяка
из трехвалентного в пятивалентное.
Литература:
[1] Фрейдлина Р.Х.// Синтетические методы в
области металлоорганических соединений мышьяка. М.; Л.: Изд. АН СССР, 1949.
180с.
[2] Эммануэль Н.М., Кнорре Д.Г.// Курс химической
кинетики. М.: ВШ, 1984. 463с.
[3] Лейдлер К.// Кинетика органических реакций.
М.: Мир, 1966. 349с.