Глянько Е.В.
Харьковский национальный университет имени В.Н. Каразина,
Украина
Анализ компонентов приспособленности и локомоторной
активности линии D. melanogster с нейрологическими нарушениями
Благодаря исследованиям
на дрозофиле был достигнут существенный прогресс в области исследований
нейродегенеративных заболеваний, в частности в идентификации генов, которые
необходимы для поддержания структурной целостности мозга. Как известно,
нейрологические мутации у человека могут приводить к ряду патологических
состояний, нарушению механизмов обучения, памяти, реализации сознания, что, в
свою очередь, влияет на продолжительность жизни и репродуктивные возможности
[5]. Поскольку было выяснено, что около 75% генов человека и D. melanogaster
обладают высокой степенью гомологии, дрозофила показала себя идеальным объектом
для моделирования подобных нейродегенераций [7]. С помощью дрозофилы можно
изучать молекулярные и клеточные изменения соответствующих групп клеток мозга
на различных стадиях болезни, от предсимптомальной стадии до полноценного
проявления. Дрозофила, как модельный объект, используется для анализа схем клеточных путей передачи,
участвующих в патогенезе болезней человека и проведения скрининга лекарственных
препаратов [4].
Приспособленность
организмов к различным условиям среды определяется, наряду с другими
показателями, жизнеспособностью и плодовитостью особей данного вида, а также
устойчивостью к голоданию, т.е. способностью выжить в экстремальных условиях
нехватки корма [1, 8]. В данной работе были изучены такие компоненты
приспособленности дрозофилы, как средняя и максимальная продолжительность жизни
(СПЖ и МПЖ) при голодании, плодовитость, жизнеспособность, процент леталей на
стадии куколки, а также локомоторная активность (ЛА) имаго.
Материалы
и методы. В эксперименте использовали линию D. melanogaster с нейрологической
мутацией dunce (dnc), а в качестве контроля две линии дикого типа, контрастные
между собой по ряду показателей приспособленности Canton-S (C‑S) и Oregon
(Or). Ген dnc является одним из генов контролирующих процессы обучения и памяти.
Он характеризуется очень большими размерами (минимум 130 т.п.н.), занимая 9
дисков политенной Х‑хромосомы и содержит 13 экзонов. Между двумя первыми
экзонами имеется интрон длинной 40 т.п.н., в котором расположено несколько
генов, кодирующих белок секреции слюнных желез Sgs-4. Между 2-м и 3-м экзонами,
в интроне длиной 70 т.п.н. располагаются еще четыре гена. Ген dnc кодирует ц‑АМФ
специфическую фосфодиэстеразу. У мутантов по данному гену повышенный уровень
ц-АМФ, вызванный распадом фосфодиэстеразы, приводит к нарушениям функций
каналов и нервной возбудимости, синаптической передачи и древовидного
разветвления нервов. При мутации dnc резко сокращается время существования
следа краткосрочной памяти. Взрослые особи, мутантные по данному гену проявляют
“центрофобное” поведение (избегание центра арены при тестировании на
локомоторную активность).
Результаты
и обсуждения. Анализ локомоторной активности имаго исследуемых линий показал,
что максимальным уровнем данного признака характеризуется линия дикого типа С-S (♀:
86,23±4,85; ♂: 109,98±5,13), а минимальным – Or (♀: 35,53±3,31;
♂: 37,16±3,65). Показатели локомоторной активности линии с
нейрологической мутацией dnc составили для самок 57,95±3,76, а для самцов 54,19±4,05.
Дисперсионный
анализ показал достоверное влияние генотипа (F=69,48 при p<0,01) на уровень локомоторной активности имаго D. melanogaster.
Влияние пола на исследуемый признак оказалось статистически значимым только для
одной линии дикого типа С-S (F=4,2 при p<0,05).
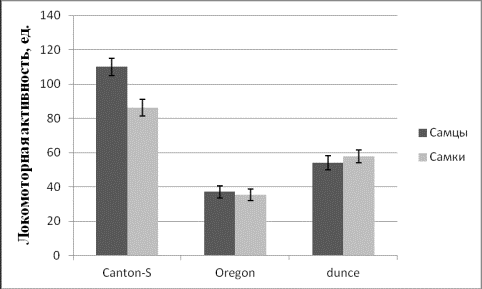
Рис.
1. Локомоторная активность имаго D. melanogaster.
В результате
исследования было показано, что линия с мутаций dnc имеет достоверно более
низкий уровень продолжительности жизни, плодовитости и жизнеспособности по
сравнению с линиями дикого типа. Изучение плодовитости данных линий показало,
что максимальным уровнем данного признака обладает линия C-S, а минимальным –
dnc (F=36; р<0,05), при том, что самым высоким процентом леталей на стадии
куколки характеризуется линия с мутацией dnc (F=17; p<0.05). При анализе жизнеспособности было
установлено, что мутантная линия dnc имеет самый низкий уровень по данному
показателю в сравнении с линиями дикого типа (F=75; p<0.05); влияние пола на жизнеспособность
оказалось статистически незначимым.
Табл. 1. Показатели
приспособленности линий D. melanogaster
|
Линии D.melano- gaster |
♀ ♂ |
ПЖ при голодании |
Жизнеспо- собность |
Плодо- витость |
% леталей |
|
|
СПЖ |
МПЖ |
|||||
|
dunce |
♀ |
48 |
58 |
40,37±2,13 |
84,95±3,7 |
11,5±1,6 |
|
♂ |
42 |
52 |
36,92±1,73 |
|||
|
C-S |
♀ |
69 |
90 |
62,65±2,03 |
129,9±3,4 |
3,7±0,27 |
|
♂ |
57 |
69 |
61,22±2,24 |
|||
|
Or |
♀ |
60 |
71 |
59,75±7,71 |
124,7±3,9 |
5,5±0,5 |
|
♂ |
51 |
66 |
57,18±7,38 |
|||
Анализ
продолжительности жизни имаго D. melanogaster при голодании показал четкие
межлинейные отличия. А именно, СПЖ dnc составила 48 ч. у самок и 42 ч. у самцов, а МПЖ соответственно 58 и
52 часа, что достоверно ниже показателей изучаемого признака у контрольных
линий дикого типа. Двухфакторный дисперсионный анализ ПЖ показал достоверное
влияние генотипа (F=66,14; p<0,001), пола (F=42,4; p<0,001) и их
совместное действие (F=6,04;p<0,05) на исследуемый признак. Средняя для
каждой линии продолжительность жизни самок выше, чем у самцов, что
соответствует сложившимся представлениям о половом диморфизме ПЖ животных и
меньшей приспособленности гетерогаметного пола.
Список
литературы:
1. Зорина
З.А., Полетаева И.И., Резникова Ж.И. Основы этологии и генетики поведения. М.
"Высшая школа", 2002 – 383 с.
2. Кайданов
Л.З., Адоньева Н.В., Каракин Е.И. Нейрогенетика дрозофилы и проблемы
нейробиологии // Информационный вестник ВОГиС. №9.
1999 г.
3. Лакин Г.Ф.
Биометрия. – Москва: Высшая школа, 1990. – 351с
4. Bilen J., Bonini N. M. Drosophila as a model for
human neurodegenerative disease // Annual Review of Genetics. – 2005. –Vol. 39.
– P. 153-171.
5. Bingwei Lu. Recent advances in using Drosophila to
model neurodegenerative Diseases // Apoptosis. – 2009. –Vol. 14. P. 1008–1020.
6. Burnet B., Burnet L., Connolly K., Williamson N. A
genetic analysis of locomotor activity in Drosophila melanogaster // Heredity. –
1988. – Vol. 61. P. 111‑119.
7. Celotto A. M., Palladino M. J. Drosophila – A
“Model” model system to study neurodegeneration // Molecular interventions. – 2005.
– Vol. 5. P. 292–303.
8. Connolly K. Locomotor activity in Drosophila //
Anim. Behav. – 1967. – Vol.14. – P. 444–449.