Биологические науки/9. Биохимия и биофизика
К.б.н,
доцент Иванов В.В., к.м.н. Шахристова Е.В., д.м.н., профессор Степовая Е.А.,
к.м.н. Носарева О.Л., д.м.н., профессор Рязанцева Н.В., д.м.н., профессор,
академик РАН Новицкий В.В.
ГБОУ ВПО
СибГМУ Минздрава, г. Томск, Россия
Стимулированный липолиз и окислительная модификация белковых молекул в
адипоцитах крыс с аллоксановым диабетом
Окислительный стресс является важным патогенетическим
фактором возникновения инсулинорезистентности при сахарном диабете (СД) 1 и 2 типа. Одним
из биологических эффектов инсулина является его ингибирующее действие на
стимулируемый катехоламинами липолиз в жировой ткани. В механизме
диабетогенного действия аллоксана лежит его способность генерировать активные
формы кислорода, вызывающие окислительную модификацию белков (ОМБ) и липидов. Цель
исследования: изучение интенсивности стимулированного изопротеренолом липолиза,
ингибирующего влияние на него инсулина и степень окислительной модификации
белков в изолированных адипоцитах крыс с аллоксановым диабетом.
Исследования проведены на 23 крысах-самцах Wistar массой 210±25 г. согласно «Правилам проведения работ
с использованием экспериментальных животных» (приказ МЗ СССР № 755 от
12.08.1977 г.) и Федеральному Закону «О защите животных от жестокого обращения»
от 01.09.1997 г., а также с соблюдением конвенции по защите позвоночных
животных, используемых для экспериментальных и других научных целей, принятой
Европейским союзом в 1986 году. Экспериментальный СД у животных вызывали инъекцией аллоксана
(90 мг/кг четерехкратно). Из эпидидимальной жировой ткани выделяли адипоциты с
использованием коллагеназы [1]. Интенсивность липолиза оценивали по
концентрации глицерола в среде инкубации адипоцитов, определяемого
ферментативным методом [2]. Стимуляцию липолиза осуществляли β2-агонистом
изопротеренолом в конечной концентрации 1 мкМ. Об интенсивности свободнорадикального
окисления в адипоцитах судили по содержанию карбонильных производных белков
(КПБ), определяемых методом, основанным на реакции окисленных остатков
аминокислот с 2,4-динитрофенилгидразином [3], битирозина и окисленного
триптофана флюориметрическим методом [4]. Образование активных форм кислорода в
адипоцитах определяли с помощью флюоресцентного зонда
2,7-дихлорфлюоресцеиндиацетата (ДХФДА, 5 мкМ), измеряли интенсивность
флюоресценции на Rotor Gene 6000 (Германия, λвозбуждения=470 нм,
λиспускания=510 нм). Визуализацию интенсивности
флюоресценции проводили на микроскопе Axioscop 40 («Carl Zeiss», Германия,
объектив 20; диафрагма 6,3; λвозбуждения=500 нм; λиспускания=520 нм).
Результаты обрабатывали с помощью непараметрических критериев Краскала-Уолиса и
Манна-Уитни.
В ходе экспериментов установлено, что в адипоцитах
крыс с аллоксановым СД наблюдается увеличение спонтанного липолиза (р<0,05)
(рис.1). В тоже время агонист β2-адренорецепторов изопротеринол
в меньшей степени стимулирует липолиз в адипоцитах этих животных (у контрольных
крыс в 3,7 раза (р< 0,05) и в 1,9 раза (р< 0,05) у крыс с
аллоксановым СД) (рис. 1).
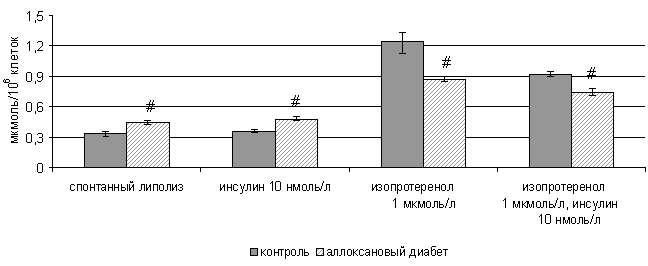 #- р<0,05
уровень значимости различий по сравнению с адипоцитами контрольной группы
#- р<0,05
уровень значимости различий по сравнению с адипоцитами контрольной группы
Рис. 1. Влияние инсулина и изопротеренола на липолиз в
изолированных адипоцитах крыс с аллоксановым диабетом
В адипоцитах крыс с СД снижена способность инсулина
(10 нМ) ингибировать стимулированный изопротеренолом гидролиз триацилглицеролов
по сравнению с контролем (на 14% (р<0,05) и 26% (р<0,05) соответственно)
(рис.1).
Одной из причин нарушения трансдукции гормональных
сигналов в адипоцитах при экспериментальном СД может быть окислительный стресс
в жировой ткани, вызванный хронической гипергликемией. Наряду с этим, аллоксан
в диабетогенных дозах в экспериментах in vitro
индуцирует продукцию активных форм кислорода в изолированных адипоцитах, о чем
свидетельствует увеличение флюоресценции клеток, нагруженным зондом ДХФДА (рис.
2).
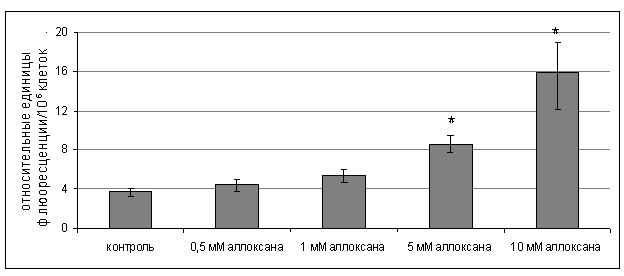
*- р<0,01
уровень значимости различий по сравнению с адипоцитами контрольной группы
Рис. 2. Интенсивность флюоресценции активных форм
кислорода в адипоцитах, нагруженных 2,7-дихлорфлюоресцеиндиацетатом, при
действии аллоксана.
Нами выявлено повышение (р<0,01) уровня спонтанной
ОМБ в адипоцитах, изолированных из жировой ткани крыс с аллоксановым диабетом,
При длинах волн 274 нм и 363 нм в адипоцитах крыс с аллоксановым
диабетом выявлено увеличение концентрации карбонильных производных в 5,8 и 3,8
раза, соответственно по сравнению со спонтанным уровнем ОМБ в адипоцитах
контрольных животных (рис. 3).
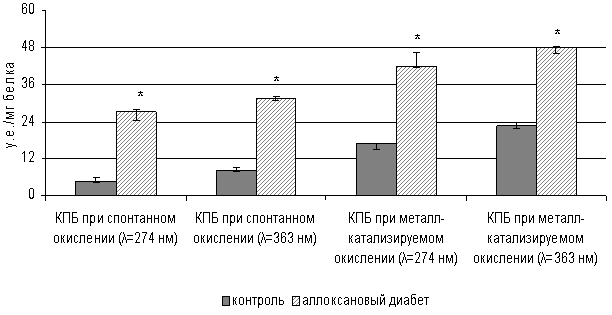
*- р<0,01
уровень значимости различий по сравнению с адипоцитами контрольной группы
Рис. 3. Содержание карбонильных производных белков
(КПБ) в адипоцитах крыс с аллоксановым диабетом
Для стимуляции процессов окисления использовались
компоненты системы Фентона. При исследовании металл-катализируемой ОМБ в
адипоцитах крыс с аллоксановым диабетом возрастало содержание карбонильных
производных в 2,5 и 2,1 раза при длинах волн 274 нм и 363 нм (р< 0,01),
соответственно по сравнению с уровнем металл-катализируемой ОМБ в адипоцитах
контрольных крыс (рис. 3). В адипоцитах крыс с аллоксановым диабетом содержания
битирозина и окисленного триптофана увеличивается в 1,5 раза и 1,4 раза
соответственно по сравнению с контролем (рис. 4).
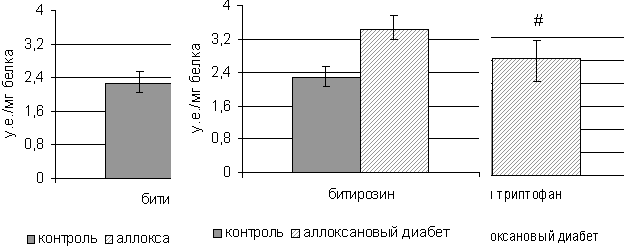
*- р<0,01
уровень значимости различий по сравнению с адипоцитами контрольной группы
#- р<0,05
уровень значимости различий по сравнению с адипоцитами контрольной группы
Рис. 4. Содержание битирозина и окисленного триптофана
в адипоцитах крыс с аллоксановым диабетом
Увеличение ОМБ является ранним маркером окислительного
повреждения адипоцитов, при котором белки выступают в роли эффективных ловушек
генерируемых активных форм кислорода.
Таким образом, активация свободнорадикального окисления
в жировой ткани при аллоксановом диабете приводит к увеличению степени
окислительной модификации белков в адипоцитах, что может сопровождаться
нарушениями трансдукции гормональных сигналов и способствовать снижению ее
чувствительности к инсулину.
Литература:
1. Rodbell M.
Metabolism of isolated fat cells // Biol. Chem. – 1964; 239: 375-380.
2. Wieland O.N.
Glycerol In // Methods of Enzymatic Analysis. – Verlag Chemei. Germany, 1984.
P. 504-510.
3. Арутюнян А.В., Дубинина Е.Е., Зыбина Н.Н. Методы
оценки свободнорадикального окисления и антиоксидантной защиты организма. –
СПб., ИКФ «Фолиант» 2000.-104 с.
4. Davies K.J.
Protein damage and degradation by oxygen radicals. 1. General aspects // J.
Biol. Chem. – 1987; 262: 9895-9901.
