Химия и химические
технологии/
5. Фундаментальные
проблемы создания новых материалов и технологий
К.х.н. Фогель Л.А.,
д.х.н. Стацюк В.Н., Иманбаева А.Б.
АО «Институт
органического катализа и электрохимии им. Д.В. Сокольского» Республика
Казахстан
ЭЛЕКТРОХИМИЧЕСКОЕ ПОВЕДЕНИЕ ЛАТУННОГО
ЭЛЕКТРОДА В ПРИСУТСТВИИ ЛИГНОСУЛЬФОНАТА
НАТРИЯ
С целью создания многофункциональных
ингибиторных композиций на основе фосфорсодержащих комплексонов [1-4] и
усиления их способности предотвращать солеотложение вводят различные
соединения. Особое место занимают композиции на основе дешевого и доступного в
промышленном объёме сырья. Наиболее целесообразным может быть включение в
ингибиторную композицию лигносульфоната натрия. Это соединение относится к
полимерным электролитам и является анионным ПАВ. Полифункциональность этого
соединения обусловлена наличием метаксильных, фенольных, карбонильных и карбоксильных
групп [5,6], обладающих ярко выраженной способностью связывать ионы жесткости.
Однако
электрохимическая активность лигносульфоната натрия и его способность влиять на
коррозионные процессы практически не исследована, что особенно важно при
использовании лигносульфоната натрия в составе ингибиторных композиций на нефтепромысловом
оборудовании Западного Казахстана, когда наряду с процессами солеотложения, как
правило, имеют место сильно выраженные коррозионные процессы.
Настоящая работа посвящена исследованию
электрохимического поведения лигносуфоната натрия на латунном электроде (Л 63)
и его влиянию на коррозионные процессы. Электрохимическое исследование
проводили методом снятия циклических вольтамперных кривых на потенциостате Gamry
Reference 3000 (США), в герметичной трехэлектродной
ячейке при 250С. Рабочим электродом служил латунный электрод Л 63 с
видимой поверхностью 0,03 см2. Вспомогательным электродом был
платиновый электрод с поверхностью 2 см2. В качестве электрода
сравнения использовали хлорсеребряный электрод (Ag/AgCI,
нас. KCI) с потенциалом 196 мВ относительно водородного электрода.
Фоновым электролитом служил раствор 0,3М Na2SO4
(соль
Na2SO4 “х.ч„). Лигносульфонат
натрия (пр-во ALDRICH, Германия) имел квалификацию «х.ч.», м.в. =
52.0. Циклические вольтамперные кривые снимали в интервале потенциалов от 0,5
до -1,1 В с последующим изменением развертки потенциала.
На рисунке
1приведены циклические вольтамперные кривые, полученные на латунном электроде в
0,3 М Na2SO4 (рН=5,8) без
лигносульфоната натрия (рисунок 1а) и с добавкой лигносульфоната натрия
(рисунок 1б).
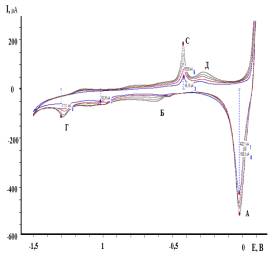
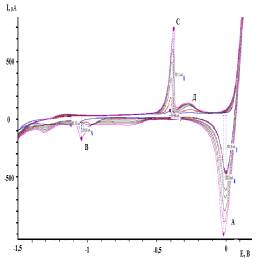
а б
Концентрация
лигносульфоната натрия (М): 1- 0; 2 – 3,8.10-3
Рисунок
1 – Циклические вольтамперные кривые латунного электрода в 0,3 М Na2SO4
(рН=5,8)
Согласно
рисунку 1а на циклических вольтамперных кривых латунного электрода в катодной
области наблюдается четко выраженный максимум тока (А) Е= 0 В. Величина тока
этого максимума составляет 0,422 мА. Помимо характеристического максимума (А) в
катодной области наблюдается пологий
максимум (Б) (Е= -0,52 В) и небольшой максимум тока (Г) (Е=-1,3 В). На
обратном ходе вольтамперных кривых наблюдается анодный максимум тока (С) (Е=
-0.43 В, Iм = 0,214 мА) и пологий максимум (D) (Е=-0,27 В).
Увеличение
числа циклов приводит к незначительному росту тока максимумов (А), (С) и (D).
В присутствии лигносуфоната натрия (рисунок 1 б) при циклировании происходит
значительный рост тока катодного максимума (А), появление катодного максимума
(В) (Е =1,02 В) и увеличение тока максимума (С). Потенциал максимума тока (А)
по мере циклирования смещается в сторону отрицательных значений, что
свидетельствует о влиянии продуктов, образующихся при анодной поляризации
латунного электрода в присутствии лигносульфоната натрия, на протекание катодной
реакции.
Более
наглядно влияние лигносуфоната натрия на ход циклических вольтамперных кривых
(первый и седьмой циклы) латунного электрода видно из зависимостей величин тока
максимумов (А) и (С) от концентрации лигносульфоната натрия (рисунок 2).
В
соответствии с рисунком 2 на первом цикле
вольтамперных кривых латунного электрода величины тока максимумов (А) и
(С) меняются незначительно. С увеличением числа циклов наблюдается рост тока
максимумов (А) и (С). На седьмом цикле происходит резкий рост тока максимумов
(А) и (С) с увеличением концентрации лигносульфоната натрия вплоть до
концентрации 3,8.10-3 М. При дальнейшем росте концентрации лигносульфоната натрия
величина тока (А) несколько понижается, а величина тока максимума (С) остается
практически постоянной.
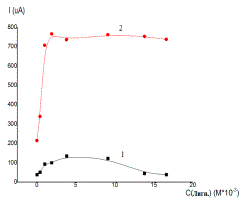
а б
Обозначения
кривых: а- максимум (А); б – максимум (С); № цикла: 1-1; 2-7.
Рисунок 2 – Влияние
лигносульфоната натрия на величину тока максимумов (А) и (С) на циклических
вольтамперных кривых латунного электрода в 0,3 М Na2SO4
(рН=5,8)
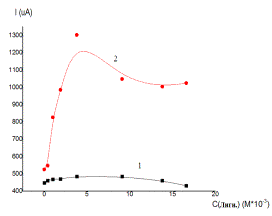
В
соответствии с рисунком 2 на первом цикле
вольтамперных кривых латунного электрода величины тока максимумов (А) и
(С) меняются незначительно. С увеличением числа циклов наблюдается рост тока
максимумов (А) и (С). На седьмом цикле происходит резкий рост тока максимумов
(А) и (С) с увеличением концентрации лигносульфоната натрия вплоть до
концентрации 3,8.10-3 М. При дальнейшем росте концентрации лигносульфоната натрия
величина тока (А) несколько понижается, а величина тока максимума (С) остается
практически постоянной.
Таким образом, сопоставляя циклические
вольтамперные кривые латунного электрода в растворах, близких к нейтральным,
следует отметить, что присутствие лигносульфоната натрия приводит к изменению
величин тока и потенциалов анодных и катодных максимумов, что может быть
обусловлено образованием на поверхности электрода комплексных соединений ионов
меди с лигносуфонатом натрия.
Литература:
1.
Дятлова Н.М., Тёмкина
В.Я. Попов К.И. Комплексоны и комплексонаты металлов. Москва: Химия, 1988. 539
с.
2.
Бондарь Ю.Ф., Маклакова
В.П., Гронцит Р.К. Применение фосфорорганических соединений для борьбы с
накипеобразованием в оборотных системах охлаждения // Теплоэнергетика. – 1976,
№ 1. – С.70-73.
3.
Стацюк В.Н., Фогель
Л.А., Айт С., Иманбаева А.Б.
Электродные реакции на латунном и медном электродах в растворах
ингибиторов коррозии на основе фосфоновых кислот // Материалы Международного
российско-казахского семинара «Проблемы современной электрохимии и коррозии
металлов». – Тамбов, 2013. – С. 2325-2329.
4.
Стацюк В.Н., Фогель
Л.А., Ахмет О., Тилепберген Ж.Ж. Электродные
реакции латунного электрода в растворах НТФ и ОЭДФ // Известия НАН РК (сер.
хим.). - 2012. - № 3. – С.54-59.
5.
Сарканен К.Х., Людвиг
Г.В. Лигнины (структура, свойства и реакции). М.: Наука, 1975.- 632 с.
6.
Бровко О.С.,
Паламарчук И.А., Макаревич Н.А., Бойцова Т.А. Полимолекулярные
характеристики лигносульфонатов натрия, хитозана и полиэтиленполиамина //
Химия растительного сырья.- 2009.- №1.- С. 29–36.