Химия и химические
технологии/6. Органическая химия
А.А.
Кукушкин, А.В. Скрипальщикова, Е.В. Кулумаева,
к.х.н. Е.В.
Роот, д.х.н. М.С. Товбис
ПОИСК
ОПТИМАЛЬНЫХ УСЛОВИЙ синтеза И ИДЕНТИФИКАЦИЯ пиридилзамещенных
пара-нитрозофенолов
«Сибирский государственный технологический
университет» г. Красноярск
Известно, что полностью замещенные
аминофенолы с алкоксикарбонильными группами в бензольном ядре обладают
бактериостатической активностью in vitro по отношению к бактериям E. coli и S. Aureus и
проявляют анальгетические свойства in vivo [1, 2]. Такие аминофенолы получают восстановлением
соответствующих перзамещенных нитрозофенолов [3]. Учитывая практическую
значимость подобных соединений, представляется важным разрабатывать методы
получения перзамещенных нитрозофенолов, содержащих пиридиновые фрагменты.
Ранее нами уже была показана принципиальная
возможность образования γ- и β-пиридилзамещенных пара-нитрозофенолов путем
циклоконденсации изонитрозо-β-дикарбонильных соединений,
содержащих пиридиновый фрагмент, с эфирами ацетондикарбоновой кислоты [4].
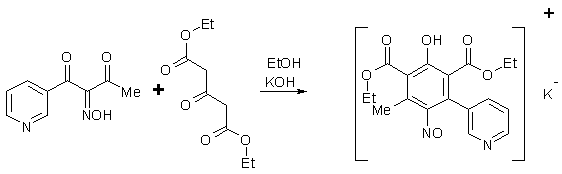
Однако до сих пор строение этих
нитрозофенолов не было строго доказано; выход продуктов был недостаточно высок.
Более того, было замечено, что при увеличении времени протекания реакции
количество целевых нитрозофенолов сначала возрастало, затем уменьшалось почти
до полного исчезновения.
Поэтому целью нашей работы стало получение
строгих доказательств строения пиридилзамещенных пара-нитрозофенолов и определение оптимального времени проведения
их синтеза.
Для установления оптимального времени
осуществления синтеза нитрозофенолов изучали изменение степени их накопления
спектрофотометрическим методом на приборе Helios Omega. Об изменении
концентрации целевого нитрозофенола во
времени судили по величине оптической плотности на аналитической длине волны
650 нм, так как нитрозофенолы имеют максимум поглощения n- π* перехода в этой области длин волн.
Для проведения эксперимента растворяли в
2,5 мл абсолютного этилового спирта при комнатной температуре 0,14 г едкого
кали, вносили 2,5 ммоль изонитрозо-β-пиридоилацетона
и перемешивали до полного растворения, затем медленно, при перемешивании
добавляли 5 ммоль диэтилового эфира ацетондикарбоновой кислоты (ДЭЭАДКК) при
температуре 25 °С (схема 1).
Из реакционной массы через каждые 5 минут
с момента добавления ДЭЭАДКК отбирали аликвоту 0,1 мл, которую растворяли в
0,1н растворе гидроксида натрия, разбавляли до достижения рабочей концентрации
0,001 моль/л и проводили измерения оптической плотности на длине волны 650 нм. Зависимость
степени накопления 2,6-ди(этоксикарбонил)-3-метил-5-β-пиридил-4-нитрозофенола от времени реакции приведена на
рис.1.
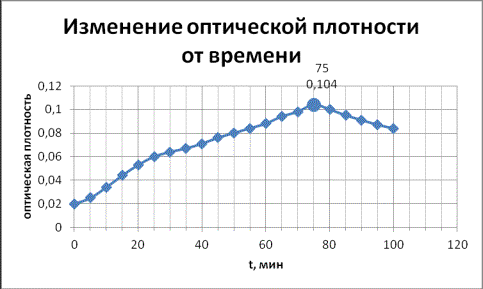
Рисунок 1- Изменение степени
накопления 2,6-ди(этоксикарбонил)-3-метил-5-β-пиридил-4-нитрозофенола
во времени
Из данных графика видно, что при
достижении 75 минут концентрация нитрозофенола была максимальной, после чего
стала снижаться. Таким образом, нами было найдено оптимальное время синтеза для
калиевой соли 2,6-ди(этоксикарбонил)-3-метил-5-β-пиридил-4-нитрозофенола. В аналогичных условиях мы
синтезировали 2,6-ди(метоксикарбонил)-3-метил-5-β-пиридил-4-нитрозофенол, 2,6-ди(метоксикарбонил)-3-метил-5-γ-пиридил-4-нитрозофенола.
Для калиевых солей всех пиридилзамещенных
нитрозофенолов мы записали спектры ЯМР 1Н,
ЯМР 13С на приборах Bruker Avance III 600 (Красноярский региональный центр коллективного
пользования СО РАН) для растворов соединений в D2O. Кроме того, сделано точное отнесение сигналов
с помощью двумерной спектроскопии 1Н-13С-HSQC.
В ЯМР 1Н спектрах присутствуют сигналы протонов ароматического ядра пиридина
(7,17-8,51 м. д.), алкильных групп, связанных с кислородом (3,91-4,36 м. д.) и
метильной группы, связанной с ароматическим ядром (2,30 м. д.). В спектрах ЯМР
13С есть сигналы ядер углерода (170
м. д. и 181 м. д.), которые указывают на наличие нитрозо- и гидроксигрупп,
что подтверждает строение полученных веществ.
В результате работы синтезировано 3 новых
соединения, строение которых доказано методом ЯМР 1Н, ЯМР 13C и найдено оптимальное время
синтеза для полученных соединений.
Список литературы
1.
Толстикова Т.Г.,
Слащинин Д.Г., Долгих М.П., Товбис М.С. Анальгетическая активность нового
перзамещенного пара-аминофенола [Текст] / Статья в сборнике материалов VI Региональной научно-практической конференции КГПУ им.
В.П.Астафьева «Химическая наука и образование Красноярья», 2012 г. – С. 76–78.
2.
Товбис М.С., Соколенко
В.А., Слащинин Д.Г., Роот Е.В., Задов В.Е. Гексазамещенные пара-аминофенолы со сложноэфирными группами в 2,6-положениях по отношению к гидроксилу /
Патент РФ № 2410371 Опубл. Б.И.2011. № 3.
3.
V. A. Sokolenko, D. G. Slashchinin, M. S. Tovbis, V. E. Zadov. Catalytic
hydrogenation of persubstituted p-nitrosophenols / Russian Journal of Organic Chemistry. 2010.
V.46. Issue 4. P. 517-519.
4.
Кукушкин А.А., Роот
Е.В., Товбис М.С. Получение новых перзамещенных пара-нитрозофенолов, содержащих
пиридиновый фрагмент [Текст] / Лесной и химический комплексы – проблемы и
решения. Всероссийская научно-практическая конференция. Сборник статей по
материалам конференции. Красноярск: СибГТУ, Том 2, 2013, С. 72-73.