Химия
и химические технологии/6. Органическая химия
к.х.н. Жусупбекова Н.С.
Казахский Национальный
Университет им. Абая, Казахстан, г. Алматы
Синтез циансодержащих эфиров
фосфорной кислоты
и их биологическая активность
Ранее было показано, что циангидрины
алифатического, ациклического и гетероциклического рядов фосфорилируются
диалкилфосфористыми кислотами с образованием циансодержащих производных, что
открывает перспективы создания новых эфиров фосфорной кислоты, потенциально
обладающих биологической активностью [1-6].
Продолжая направления в данном
направлении, было изучено взаимодействие ацетонциангидрина (1) с диэтил- (2),
дипропил- (3), ди-(b-хлорэтил)- (4), дибутил- (5), диаллил- (6) и дипропаргилфосфитами (7).
Синтезированы и охарактеризованы соответствующие циансодержащие триалкилфосфаты
(8-13).
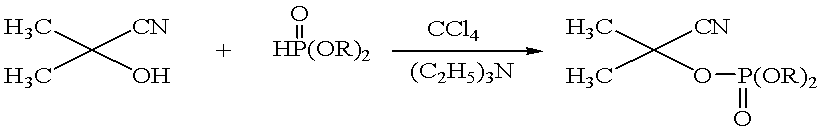
1 2-7 8-13
R = C2H5 (2,8), C3H7 (3,9),
CH2CH2Cl (4,10), C4H9 (5,11), CH2-СН=CH2
(6,12),
CH2-СН≡CH (7,13)
Состав и строение полученных соединений
(8-13) подтверждены данными элементного анализа, ЯМР 1Н, 13С,
31Р и ИК спектроскопии, индивидуальность – тонкослойной
хроматографией в системе растворителей – гексан : ацетон : этилацетат - 8:3:9,
А12О3 (таблицы 1-3).
В ИК спектрах соединений (8-13) имеются
полосы поглощения в области 1209-1280 см-1, характерные для
Р=О–группы, в интервале 1005-1035 см-1 наблюдаются полосы поглощения
связи Р-О-С. Отсуствуют полосы поглощения, соответствующие ОН–группе исходного
нитрила.
Таблица 1. Физико-химические характеристики соединений
(8-13)
|
№ соед |
Вы-ход, % |
Т. кип. |
nD18 |
Rf |
Вычислено,% Найдено, % |
Брутто-формула |
||||
|
С |
Н |
N |
Р |
Сl |
||||||
|
8 |
61,0 |
89,5-93 |
1,417 |
0,75 |
43,44 43,0 |
7,24 7,04 |
6,33 6,03 |
14,03 13,52 |
- |
С8Н16NРО4 |
|
9 |
71,0 |
85-102 |
1,421 |
0,67 |
48,19 48,09 |
8,03 7,85 |
5,62 5,12 |
12,45 12,15 |
- |
С10Н20NРО4 |
|
10 |
79,0 |
139,5-142,5 |
1,458 |
0,57 |
33,10 33,0 |
4,83 4,5 |
4,83 4,48 |
10,69 10,47 |
24,48 |
С8Н14NРО4Сl |
|
11 |
75,0 |
96-103 |
1,423 |
0,68 |
51,99 50,41 |
8,66 8,27 |
5,05 4,45 |
11,19 11,09 |
- |
С12Н24NРО4 |
|
12 |
60,0 |
97-109 |
1,444 |
0,77 |
48,98 48,18 |
6,53 6,03 |
5,71 5,18 |
12,65 12,42 |
- |
С10Н16NРО4 |
|
13 |
58,0 |
115-117 |
1,463 |
0,81 |
49,79 49,27 |
4,98 4,58 |
5,81 5,62 |
12,86 12,34 |
- |
С10Н12NРО4 |
Таблица 2. ИК, КР спектры
соединений (8-13)
|
№ соед |
R |
ИК спектр, см-1 |
КР cпектр |
||||||
|
P=O |
P-O-C |
C≡N |
CH3 |
=CH2 |
≡CH |
C≡C |
vC≡N см-1 |
||
|
8 |
C2H5 |
1290 |
1035,1005 |
2215 |
2990,2880 |
- |
- |
- |
2244 |
|
9 |
C3H7 |
1285 |
1020 |
2215 |
2960,2880 |
- |
- |
- |
2244 |
|
10 |
CH2CH2Cl |
1287 |
1030 |
2250 |
2995,2890 |
- |
- |
- |
2244 |
|
11 |
C4H9 |
1290 |
1030,1010 |
2215 |
2960,2880 |
- |
- |
- |
2242 |
|
12 |
CH2-СН=CH2 |
1280 |
1030 |
2250 |
2955,2890 |
3090 |
- |
- |
2244 |
|
13 |
CH2-СН≡CH |
1285 |
1030 |
2225 |
2950,2885 |
- |
3292 |
2140 |
2244 |
Таблица 3. ПМР спектры соединений (8-13)
|
№ соед |
R |
ПМР спектр, d, м.д. |
|||||||
|
CH3 |
C≡CН |
POCН2 |
CH2-CН2 |
CH2-CН3 |
=CH2 |
CH= |
31Р |
||
|
8 |
C2H5 |
1,82 с |
- |
4,10кв.д. |
- |
1,30
т |
- |
- |
-5,6
80
Гц |
|
9 |
C3H7 |
1,70 с |
- |
3,29кв.д. |
1,57кв.д. |
0,98 |
- |
- |
-5,4 |
|
10 |
CH2CH2Cl |
1,80 с |
- |
4,20кв.д. |
3,62кв.д. |
- |
- |
- |
-6,3 |
|
11 |
C4H9 |
1,77 с |
- |
4,01кв.д. |
1,7
кв.д. |
0,85
т |
- |
- |
-6,4 |
|
12 |
CH2-СН=CH2 |
1,75 с |
- |
4,75кв.д. |
- |
- |
5,25д;
5,39 с |
5,7м |
-5,6 |
|
13 |
CH2-СН≡CH |
1,85 с |
2,60
т |
4,70кв.д. |
- |
- |
- |
- |
-6,8 |
Для соединения (12) в области 3090 см-1
проявляются полосы поглощения =СН2–связи. Валентные колебания
тройной ацетиленовой связи (СºС) соединения (13) отмечены при 2140 см-1 и полосы поглощения
характерные для терминального ацетиленового водорода ºСН–связи
наблюдаются при 3292 см-1.
В КР спектрах соединений (8-13) для СºN
группы наблюдаются полосы поглощения в области 2244-2242 см-1.
В спектрах ПМР соединений (8-13)
наблюдаются резонансные сигналы протонов в области 3,92-4,75 м.д. (квард
дублет, РОСН2), 0,85-1,30 м.д. (триплет, РОСН2СН3,
РОСН2СН2СН3, РОСН2СН2СН2СН3),
1,7-3,62 м.д. (квард дублет, РОСН2 СН2, РОСН2СН2СН3,
РОСН2СН2СН2СН3, РОСН2СН2СН2–),
2,60 м.д. (триплет, СºСН), 1,70-1,85 м.д. (синглет, СН3), 5,25 м.д. (дублет, СН=СН2),
5,39 м.д. (синглет, СН=СН2), 5,75 м.д. (дублет, СН=СН2).
Данные ЯМР спектров подтверждают структуру
синтезированных соединений (8-13). Так, в ЯМР 31Р спектре соединений
(8-13) наблюдаются сигналы в области -5,6-(-6,4) м.д., соответствующие
резонансу ядра атома фосфора.
Далее синтезированные соединения
(9,10,13) на базе кафедры микробиологии, вирусологии и иммунологии КазНМУ им.
С.Д. Асфендиярова были исследованы на антимикробную активность. Изучение
антимикробной активности проводилось по отношению к штаммам бактерий
Staphylococcus aureus, Escherihia coli, Pseudomonas aeruginosa и дрожжевому
грибу Candida albicans методом диффузии в агар (лунок).
В результате исследования установлено,
что соединение (13) обладает умеренной антимикробной и выраженной
противогрибковой активностью, а соединение (9) обладает умеренной активностью
против стафилокков и грибов кандида.
Таким образом, в результате проведенных
исследований было установлено, что циангидрины могут фосфорироваться с
диалкилфосфористыми кислотами с образованием соответствующих производных. При
исследовании синтезированных соединений (9,10,13) на биологическую активность
выявлены соединения, обладающие умеренной антимикробной и выраженной
противогрибковой активностью.
Литература
1. Джиембаев
Б.Ж. α–Окси- и α –аминофосфонаты шестичленных (N,О, S, Sе)
гетероциклов, Алматы, 2003, 234 с.
2. Мадакян
В.Н., Тосунян А.О., Мирзоян Р.Г., Вартанян С.А. Синтез стереоизомерных
2,5-диметил-4-аминотетрагидротиопиран-4-карбоновых кислот // Арм. хим. журн.
1979. Т.29. №1. С.66-70.
3. Арбузов
Б.А., Зароастрова В.М., Ибрагимов Н.Д. Эфиры фосфорной кислоты, содержащие
циангруппу // Изв. АН СССР. Сер. Хим. 1964. №4. С. 656.
4. Но
Б.И., Юхно Ю.М., Еремин С.Н., Шишкин В.Е., Медников Е.В. Окислительное
фосфорилирование α –гидроксилнитрилов // Журн. Общ. Химии. 1992. Т.62.
Вып. 1. С.228-229.
5. Салимбаева
А.Д., Джиембаев Б.Ж, Туканова С.К., Бутин Б.М. Синтез новых фосфорилированнх
ацетиленовых аминов // Журн. Общ. Химии. 1990. Т.60. вып. 5. С.1008-1011.
6. Черкасов
А.Р., Галкин В.И., Черкасов Р.А. Индуктивный эффект заместителей в
корреляционном анализе: проблема количественной оценки // Успехи химии. 1996.
Т.65. Вып. 6. С.695-711.