Змитрович
И.В.
Ботанический
институт им. В.Л. Комарова РАН, Россия
Высшие базидиомицеты и
терапия рака
За последние годы накопилось много данных об иммуноопосредованном и прямом воздействии биоактивных комплексов, продуцируемых грибами – высшими базидиомицетами на основные молекулярные мишени раковых клеток – TNF-индуцированном апоптозе, блокировке рецепторов EGF и VEGF, ингибировании циклинзависимых киназ и металлопротеиназ, связывании NF-κB [2, 3].
В основном это слабые стимулы, на этапе прогрессии опухоли способные лишь усиливать основное лечение (см. рисунок), хотя на этапе адъювантной терапии их роль возрастает.
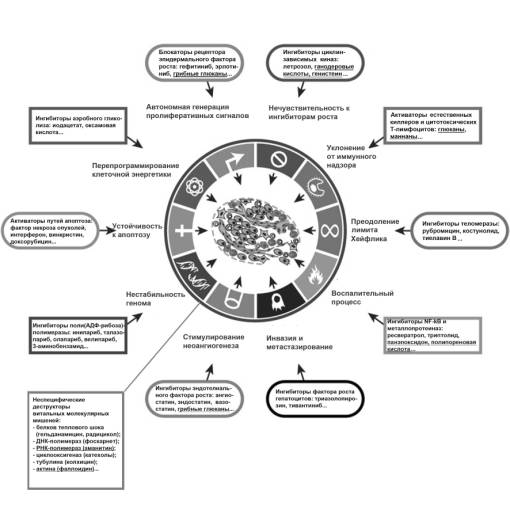
Рисунок. Аспекты рака и основные направления таргетной
терапии (по: [7], с изменениями).
Основным механизмом терапевтического воздействия грибных метаболитов является опосредованная естественными киллерными клетками (ЕКК) атака на неоплазмы, связанная со значительным снижением последними экспрессии антигенов главного комплекса гистосовместимости I типа (МНС1). Полисахариды клеточной стенки грибов ложно распознаются клетками врожденного иммунитета в качестве инвазивного клона микроорганизмов, поскольку у этой группы иммуноцитов сформирован целый класс рецепторов, настроенных на распознание молекулярных фрагментов самых разных клеточных стенок. Глюканы, маннаны, хитозан, являющиеся основными компонентами клеточных стенок грибов, выступают для иммунных клеток как один из «патоген-ассоциированных молекулярных образов», будучи комплементарными ряду рецепторов иммуноцитов (Toll-, dectin-1 рецепторы) [4]. Иммунная система распознает эти фрагменты и значительно активизируется. Поступающие в желудочно-кишечный тракт грибные полисахариды, не подвергаясь ферментативному разрушению, захватываются клетками слизистой оболочки кишечника и переносятся ими в подслизистый слой, где происходит их взаимодействие с рецепторами макрофагов и дендритных клеток, поглощающих, частично расщепляющих эти вещества и связывающих их фрагменты с молекулами МНС1. В селезенке и лимфатических узлах эти клетки стимулируют гранулоциты и ЕКК. В ходе контакта с раковыми клетками клетки-киллеры индуцируют либо Fas(ФНО)-зависимый апоптоз, либо неспецифический лизис клетки путем контаминации их цитолитическими гранулами, содержащими перфорин и гранзим B.
Повышение продукции ФНО целым рядом участников иммунного ответа создает фон, повышающий эффективность лекарственного воздействия на опухоль: наименее резистентная часть раковых клеток направляется на путь апоптоза, более резистентная – на путь аутофагии, и пролиферирующий пул, таким образом, существенно сокращается.
Тритерпеноиды (например, ганодеровые кислоты), эргостерол, клавилактоны, экстрагирующиеся вместе с грибными глюканами, ведут к G1/S и G2/M аресту клеточного цикла пролиферирующих клеток эпителия, в том числе умеренно-пролиферирующей злокачественной фракции. При сочетанном действии с химиопрепаратами такой арест выводит здоровые пролиферирующие клетки из-под лекарственной атаки, при этом раковые клетки с умеренно активными митогенными путями попадают под воздействие ЕКК. Сочетанное действие грибных экстрактов с химио- и радиотерапией достоверно увеличивает медиану выживаемости пациентов и улучшает качество их жизни [5, 6, 8, 9, 10].
Отдельно следует отметить полифенольные вещества, продуцируемые высшими базидиомицетами. Они представляют значительную емкость поглощения ионов, свободных радикалов, циркулирующих лигандов, будучи не токсичными для клетки. Продуценты полифенол-полисахаридных комплексов, например, чага (Inonotus obliquus f. sterilis) являются перспективным онкопревентивным средством [1].
Литература:
1. Баландайкин М. Э., Змитрович И. В. Чага (Inonotus obliquus f. sterilis) как фармакологически ценное
сырье и ее ресурсный потенциал // Материали за 11-а международна научна
практична конференция, «Бъдещите изследования – 2015». Том 2. Лекарство. Биологии.
География и геология. София, 2015. С. 58–59.
2. Вассер С. П. Наука о
лекарственных шляпочных грибах: современные перспективы, достижения,
доказательства и вызовы // Биосфера. 2015. Т. 7, № 2. С. 238-248.
3. Змитрович И. В. Метаболиты базидиальных грибов, эффективные в терапии рака и их молекулярные мишени: Обзор // Вестник Пермского университета. Биология. 2015. Вып. 3. С. 264–286.
4. Brown G. D., Gordon S. Immune recognition: a new receptor for β-glucans // Nature. 2001. Vol. 413. P. 36–37.
5. Fujimoto S., Furue
H., Kimura T., Kondo T., Orita K., Taguchi T. Clinical outcome of postoperative
adjuvant immunotherapy with schizophyllan for patients with resectable gastric
cancer – a randomized controlled study // Eur. J. Cancer. 1991. Vol. 27. P.
1114‒1118.
6. Gordon M., Guralnik
M., Kaneko Y., Mimura T., Goodgame J., DeMarzo C. A phase II controlled study
of a combination of the immune modulator, lentinan, with didanosine (DDI) in
HIV patients with CD4 cells of 200–500/MM(3) // J. Med. 1995. Vol. 26. P.
193–207.
7. Hanahan D., Weinberg
R. A. Hallmarks of cancer: the next generation // Cell. 2011. Vol. 144. P.
646–674.
8. Kodama N., Komuta K.,
Nanba H. Can maitake MD-fraction aid cancer patients? // Alt. Med. Rev. 2002.
Vol. 7. P. 236–239.
9. Mitomi T., Tsuchiya
S., Iijima A., Aso K., Suzuki K., Nishiyama K. Randomized, controlled study on
adjuvant immunochemotherapy with PSK in curatively resected colorectal cancer
// Dis. Colon Rectum. 1992. Vol. 35. P. 123–130.
10. Taguchi T., Furue
H., Kimura T., Kondoh T., Hattori T., Itoh A. Life-span prolongation effect of
lentinan on patients with advanced or recurrent colorectal cancer // Int. J.
Immunopharmacol. 1982. Vol. 4. P. 271.