Д.х.н. Гаджилы
Р.А.1, к.м.н. Зейналова С.К.2, д.м.н. Караев З.О.2,
к.х.н. Алиев
А.Г.1, м.н.с. Караева А.Р.1, к.ф.х. Ибрагимов Р.И.2.
1Институт полимерных материалов НАН
Азербайджана,
2Азербайджанский медицинский университет
Поиск
новых антимикробных средств в ряде
производных
пиррола
Ядро пиррола встречается в составе некоторых природных физиологически
активных соединений. Так например, ядро пиррола и продукты его восстановления
содержатся в молекулах гемоглобина, порфиринов, пигментов желчи, алкалоидов а
также некоторых аминокислот. Они выполняют в организме жизненно важные
физиологические функции. Производные пиррола находят широкое применение в
медицинской практике в качестве лекарственного средства. Так например, тавегил, пирацетам, гемодез и др.
являются производными пиррола [1]. Функциональнозамещенные пиррола
применяются в тонком органическом синтезе для получения новых
представителей пиррола, а также их конденсированных производных [2].
С целью получения новых производных пиррола гетероциклизацией 1-алкил(фенил)-4-бром-2-бутен-1-онов
с первичными аминами и синтезированы ранее неописанные производные пиррола
изучена их антимикробная активность.
Установлено, что взаимодействие 1-алкил(фенил)-4-бром-2-бутен-1-онов
1 а-г с 2-аминофенолом в водно-спиртовой среде в присутствии эквимольярного К2СО3
(для связывания выделившегося НBr), при температуре 75-80°С в течение 7 ч приводит к получению
2-алкил(фенил)-1-(2-гидроксифенил)пирролов 2 а-г 63-72%-ными выходами. А в
случае бромкетонов 1 а-г с трехкратными 25%-ным водным раствором метиламина в
среде этанола при температуре 25-30°С в течение 8 ч приводит к получению
2-алкил(фенил)-1-метилпирролов 3 а-г с 57-67%-ными выходами.
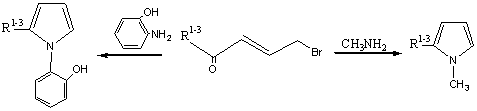
2а-г 1а-г 3а-г
R1-3= Me(a); Et(б); Pr(в); Ph(г).
4-Бром-2-бутен-1-бутен-1-оны 1а-г
содержат в своих молекулах три электрофильных центра, поэтому, при
взаимодействии с первичными аминами возможны различные направления
нуклеофильной атаки.
Характеристики пирролов 2.3 а-г Табл.1
|
Соедине- ния |
Т.кип.,0С (мм
рт. ст.) |
|
|
Брутто- формула |
Найдено, % Вычислено, % |
Выход, % |
||
|
C |
H |
N |
||||||
|
2а |
41-42/22 |
1,4925 |
0,9084 |
C6H9N |
76,79 75,80 |
9,70 9,47 |
15,32 14,74 |
72 |
|
2б |
54-56/22 |
1,4890 |
0,9007 |
C7H11N |
76,17 77,06 |
10,27 10,09 |
13,09 12,84 |
69 |
|
2в |
51-53/8 |
1,4870 |
0,8966 |
C8H13N |
78,93 78,05 |
10,69 10,56 |
11,47 11,38 |
66 |
|
2г |
82-83/5 |
1,5253 |
0,9200 |
C11H11N |
82,98 84,08 |
7,15 7,00 |
9,04 8,92 |
63 |
|
3а |
117-118/3 |
1,5810 |
1,0145 |
C11H11NO |
77,24 76,30 |
6,50 6,36 |
8,23 8,09 |
67 |
|
3б |
123-125/3 |
1,5775 |
1,0017 |
C12H13NO |
77,98 77,00 |
7,12 6,95 |
7,60 7,49 |
64 |
|
3в |
132-134/4 |
1,5440 |
0,9905 |
C13H15NO |
76,80 77,61 |
7,61 7,46 |
7,10 6,96 |
60 |
|
3г |
159-161/3 |
вязкий жидкость |
_ |
C16H13NO |
80,48 81,70 |
5,67 5,53 |
6,10 5,96 |
57 |
Наиболее вероятно, что первоначально
происходит нуклеофильное замещение атома брома на аминогруппу с образованием
непредельного аминокетона. Затем, аминокетон, за счет внутримолекулярной
атаки по углеродному атому карбонильной группы не поделённой парой
электронов атома азота и подвижным водородом с одновременным смещением
краткой связи и выделением воды,
циклизуется в пирролы. Возможно и другое направление реакции-путем атаки амина
на карбонильную группу соединения 1 а-г с образованием промежуточное основания
Шиффа, циклизация которого в пирролы невозможна.
Структура и состав
синтезированных 2,3 подтверждена данными ИК- и ЯМР 1Н спектроскопии,
а также элементным анализом.
Спектры
ЯМР 1Н пирролов Табл.2
|
Соеди-нение |
Химические сдвиги, δ, м.д.(J, Гц) |
||||||
|
Н-3, м |
Н-4, м |
Н-5, м |
ОН, С |
СН3, С |
|
R1,4 |
|
|
2 а |
5.60 |
6.00 |
6.62 |
5.20 |
– |
6.75-7.30 |
2.20 с |
|
2 б |
5.75 |
6.15 |
6.70 |
5.10 |
– |
6.80-7.33 |
1.50
т,2.75 к |
|
2 в |
5.70 |
6.20 |
6.43 |
5.35 |
– |
6.70-7.45 |
0.85т,1.52 к 2.35 т |
|
3 а |
5.68 |
6.10 |
6.65 |
– |
3.40 |
– |
2.15 с |
|
3 б |
5.75 |
6.00 |
6.55 |
– |
3.45 |
– |
1.45т,2.70
к. |
|
3 в |
5.70 |
6.20 |
6.70 |
– |
3.50 |
– |
0.80т-1.58 квин.,2.40 т. |
|
3 г |
5.64 |
6.05 |
6.65 |
– |
3.34 |
– |
7.25-7.80
м |
В ИК спектрах соединений 2,3
наблюдаются характерные полосы поглощения при 3400-3440 ( γОН
), 3010-3100(γ=СН), 1470-1580 (γс=с) 1100-1170(
δ=СН) , что хорошо согласуется литературными данными [3].
В ЯМР 1Н спектрах
присутствуют характерные [4] три мультиплетные сигналы протонов пиррольного
ядра при 5.50-5.75; 5.80-6.20 и 6.30-6.70 м.д.(3Н, 3СН ядра) соответственно в
положении 3,4 и 5 синглетные протоны группы ОН (5.10-5.50 м.д.) а также
протоны R радикала и фенильной группы.
Таким образом, реакцией 1-алкил(фенил)-4-бром-2-бутен-1-онов
с первичными аминами разработан рациональный способ получения производных
пиррола, которые являются потенциально биологически активными соединениями.
Экспериментальная часть
ИК спектры получали на Фурье-спектрофотометре
Prоtеgе-460 Nikolet c использованием тонкого слоя. Спектры ЯМР 1Н регистрировали на спектрометре Tesla Bs-567(100Mгц), внутренний
стандарт ГМДС (δ 0.05 м.д.). Растворитель СCl4. Чистоту синтезированных соединений контролировали методом ТСХ на
пластинках Silufol UV-254.
Исходные 4-бром 2-бутен-1-оны
получали по методике [2]
1-Алкил(фенил)-1-(2-гидроксифенил)пирролы
2 а-г. К смеси 2.3 г (25 ммоль) 2-аминофенола и 1.8 г (0.013 моль) К2СО3
в 50 мл воды при перемешивании
прибавляют по каплям 25 ммол соответствующего кетона 2 а-г растворенного в 30
ммол этанола при температуре 75-80°С в течение 7 ч. После охлаждения ее
промывают 50 мл насыщенного водного раствор NaCl, затем 2 раза по 30 мл экстрагируют эфиром, объединенные вытяжки сушат
MgSO4. После отгонки растворителей
остаток перегоняют в вакууме.
2-Алкил(фенил)-1-метилпирролы
3 а-г. К раствору 7.7 мл (75 ммол) 25%-ного водного раствора метиламина при
перемешивании прибавляют по каплям 25 ммоль соответствующего кетона 1 а-г растворенного в 30мл этанола при
температуре 25-30°С в течение 8 ч. По охлаждении реакционную массу промывают
2%-ным водным раствоом К2СО3.
Далее поступают по вышеописанному методу.
Изучение антимикробной
активности 2-алкил(фенил)-1-(2-гидроксифенил)пирролов 2 а-г и 2- алкил(фенил)-1-метилпирролов
3 а-г
Изучение антимикробной
активности пирролов 2.3 а-г осуществлялось путем сравнения их с общеизвестными
антимикробными средствами – этанолом, риванолом, фурациллином и нитрофунгином.
Были использованы 1%-ными спиртовые растворы испытуемых пирролов.
Антимикробная активность
пирролов 2,3 а-г была определена по методом путем серийных последовательных
разведений в стерильной диетилированной воде по отношению к грамм-положителным
бактериям (золотистый стафилококк, S. аureus), грамотрицательным
бактериям (кишечная и синегнойная палочки, P. aeruginosa, E. coli) и грибам
(кандида, C. Albicans). В качестве питательной среды для
перечисленных микроорганизмов служили МПА с рН 7,2 (для бактерий) и среда Сабура
(для грибов).
Разведение начинали с 400 мкг/мл
в зависимости от активности соединений. Высевы проводились через 10, 20, 40 и
60 мин., длительность инкубации в термостате для бактерий при
температуре 37°С составила 24 ч, а для грибов при 28°С - 48 ч. Результаты
испытаний антимикробной активности пирролов 2,3 а-г приведены в табл.3.
Антимикробная активность пирролов 2,3 а-г Табл.3
|
Тест-культур |
МПК испытуемых соединений мкг/мл |
|||||||
|
2а |
2б |
2в |
2г |
3а |
3б |
3в |
3г |
|
|
S. аureus |
33,3 |
40,0 |
33,3 |
28,6 |
66,6 |
66,6 |
50,0 |
40,0 |
|
P. aeruginosa |
60,0 |
80,0 |
40,0 |
40,0 |
200,0 |
200,0 |
100,0 |
50,0 |
|
E. coli |
200,0 |
200,0 |
100,0 |
100,0 |
400,0 |
400,0 |
200,0 |
125,0 |
|
C. Albicans |
50,0 |
40,0 |
33,3 |
28,6 |
80,0 |
50,0 |
50,0 |
25,0 |
Как видно из табл. все
испытанные соединения проявляют выражению антимикробную активность по
отношению к бактериям S. аureus и грибу рода C. Albicans. Минимальная подавляющая концентрация
(МПК) пирролов 2 а-г составляет; для S. аureus - 28,6-40,0 мкг/мл, для P. aeruginosa – 40,0-80,0 мкг/мл, для E. Coli – 100-200 мкг/мл,
а для гриба C. Albicans – 28,6-50,0 мкг/мл. МПК пирролов 3 а-г
составляет; для S. аureus - 40,0-66,6 мкг/мл, для P. aeruginosa – 50,0-200,0 мкг/мл, для E. Coli – 125-400 мкг/мл,
а для гриба C. Albicans – 25,0-80,0 мкг/мл.
1-(2-Гидроксифенил)пирролы 2 а-г
по сравнению с 1-метилпирролами 3 а-г проявляют высокую антимикробную
активность что объясняется их структурными особенностями. Сочетание в молекулах
пирролов 2 а-г фрагмента широко применяемого в медицине в качестве
антимикробного средства фенола и природного бактерицида пиррола способствует
усилению антимикробной активности пирролов 2 а-г, по сравнению с пирролами 3 а-г.
Синтезированные пирролы 2,3 а-г
проявляют высокую антимикробную активность по сравнению с широко применяемыми
в медицинской практике антимикробными средствам. Этанол, фурациллин и риванол при МПК 250-400 мкг/мл проявляют
антимикробную активность против бактерий S. аureus, P. aeruginosa и E. Coli, а при 125-200
мкг/мл против гриба C. Albicans. Нитрофунгин проявляет антимикробную
активность только против P. aeruginosa и C. Albicans при МПК 400 мкг/мл.
Литература:
1. М.Д. Машковский // Лекарственные средства. М.;
Новая волна, 2008, 1025с.
2. Р.А. Гаджилы, Р.А. Наджафова, В.Г, Джафаров //
ХГС, 1998, №6, с.769-772.
3.
Б.А. Трофимов, Н.Н. Голованова, А.И. Михалева // ХГС, 1997, №7, с.910-914.
4.
А. Гордох, Р. Форд // Спутник химика, М.; Мир, 1976, с 271-312.