Химия и химическая технология/ 7. Неорганическая
химия
Щірова К.О,
к.т.н. Кравченко І.В.
Східноукраїнський
національний університет імені Володимира Даля, Україна
Виробництво нітратної
кислоти з використанням фотосинтезу NO
Важливою проблемою сьогодення є скорочення споживання
природного газу у хімічній промисловості. Мета роботи полягає в розробці
технології отримання нітратної кислоти, де вихідною сировиною є не коштовний
аміак, для утворення якого використовують водень, отриманий конверсією метану,
а атмосферне повітря.
Зв'язування азоту може здійснюватись фотохімічно в
атмосфері за допомогою атомарного синглетного кисню [1,2]:
О2 + hn® О(3P) + О(1D)
(1)
N2 + О(1D) ® N2O (2)
Нітроген геміоксид, який утворюється за тепловою
реакцією (2), може далі окиснюватись до цільового нітроген оксиду та
відновлюватись знову до азоту майже з рівними селективностями [3]:
N2O + О(1D) ® 2NO
(3)
N2O + О(1D) ® N2 + O2 (4)
Джерелом синглетного атому кисню серед
доступних окисників може бути нітроген диоксид, здатний до двохфотонного
поглинання з переходом у збуджені стани та утворенням О(1D) [4]:
NО2+ hn ® NO2*, l=430-435 нм (5)
NO2*+
hn® NO+ O(1D), l=435-449 нм (6)
Вивчення процесів фотоокиснення N2 та
N2O здійснювалось нами на лабораторній установці безперервної дії у
кварцових реакторах при опроміненні газових сумішей ртутними лампами ПРК-2
(діапазон довжин хвиль 365-579 нм). Приріст кількості NO2, що
утворюється від окиснення азоту повітря при опромінюванні склав до 18%, що
значно перевищує відомі досягнення зв’язування азоту різними методами (2-8%).
На рис. наведено технологічну схему безвідходного
фотохімічного виробництва неконцентрованої нітратної кислоти окисненням N2.
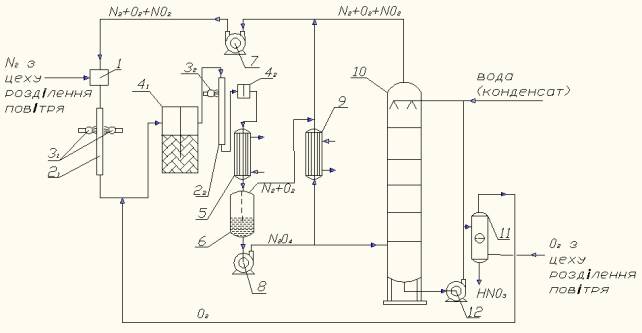
Газова суміш N2+О2+NO2
в необхідному співвідношенні готується у змішувачі поз.1, куди молекулярний
азот дозується з цеху розділення повітря, тобто інертні домішки аргону
відсутні, що дозволить нітрозні гази, які не поглинулися при абсорбції,
повернути на стадію окиснення N2, тобто стадія каталітичної очистки відкидних
газів виключається як непотрібна. У трубі поз.21, що виготовляється
з кварцу, реакційна газова суміш опромінюється ртутними лампами поз.31,
де в результаті фотоокиснення N2 збудженими частками утворюється NО
за послідовністю реакцій (5,6,2,3).
На виході з реактора опромінення поз.21
виходить суміш газів NО+N2О+N2+О2. У
доокиснювачі поз.41 нітроген оксид NО окиснюється у NО2
киснем, який дозується також з цеху розділення повітря. Далі у кварцовій трубці
поз.22 в результаті опромінення суміші газів NО2+N2О+N2+О2
ртутною лампою поз.32 проходить окиснення N2О за
реакціями (5,7,8):
NO2*+ N2О®3 NО, (7)
NO2*+ N2О® N2+ О2+ NО. (8)
Суміш газів NО+N2+О2
з реактора поз.22 йде у окиснювач поз.42 і перетворюється
у суміш NО2+N2+О2, яка охолоджується у
холодильнику-конденсаторі поз.5, де NО2 конденсується у рідкий N2О4
та в сепараторі поз.6 N2+O2 відокремлюється від N2O4.
Гази направляються на циркуляцію в змішувач поз.1 через газодувку поз.7, а
рідкий N2О4 насосом поз.8 подається у теплообмінник поз.9
та в колону абсорбції поз.10. У теплообміннику поз.9 частина рідкого N2О4
розкладається до газоподібного NО2 і далі через газодувку поз.7 йде
на циркуляцію у змішувач поз.1. У колоні поз.10 рідкий N2О4
і газоподібний NО2 реагують з водою і утворюють нітратну кислоту.
Для набуття товарного виду нітратна кислота з низу абсорбційної колони поз.10
подається у колону видування розчинених нітрозних газів поз.11 за допомогою
кисню, що надходить з цеху розділення повітря. Знизу колони поз.11 нітратна
кислота видається споживачеві.
Таким чином, технологія одержання нітратної
кислоти буде відрізнятися від існуючої відсутністю стадії окиснення аміаку, але
доповнена вузлами змішування NO2 з повітрям у заданому
співвідношенні та фотоокиснення суміші, а також конденсації NO2 у N2O4.
Частка сконденсованого N2O4 рециркулює на стадію
фотоокиснення, а решта направляється на абсорбцію та видування нітроген оксидів.
Сировиною для такого процесу можуть бути як
очищені від аргону азот та кисень, так і атмосферне повітря (за наявності
системи каталітичної очистки відкидних газів).
Література:
1.
JPL
Publication 10-06 “Chemical Kinetics and Photochemical Data for Use in
Atmospheric Studies” [Електронний ресурс] / National Aeronautics and
Space Administration, Jet Propulsion Laboratory California Institute of
Technology, Pasadena, California – Режим доступу: http://jpldataeval.jpl.nasa.gov/pdf
/JPL%2010-6%20Final%2015June2011.pdf – Evaluation Number 17, 2011.
2.
Леонтьев А.В.
Современная химия оксида азота (І) / А.В. Леонтьев, О.А. Фомичева, М.В. Проскурнина, Н.С. Зефиров //
Успехи химии. – 2001. – Т. 70 (2). – С. 107-121.
3.
Kummer W. In
situ Bildung von Distickstoffoxid in der Atmosphäre:
Diodenlaserspektroskopische Laboruntersuchung zu Bildungsprozessen und
Berechnung der globalen Quellstärken / Diss. zur Erlangung des Grades Doktor
der Naturwissenschaften dem Fachbereich Chemie – Universität GH Essen,
1999. – 147 p.
4.
Crowley
J.N. OH formation in the
photoexcitation and
of NO2 beyond the dissociation threshold in
the presence of water vapor / J.N. Crowley,
S.A. Carl // J. Phys.
Chem. A. – 1997.
– Т. 101 (23). – P. 4178-4184.