Бокарева
Е.А., Алдажаров Т.М., Аринов А.Б., Утегенова М.Е.
Восточно-Казахстанский
Государственный Технический
Университет
им.Д.Серикбаева
Определение
содержания хлоридов (Cl-) в питьевой Воде (аргентометрия)
Титриметрические определения хлоридов основаны на реакциях образования осадков малорастворимых соединений. Не все реакции сопровождающиеся выпадением осадков применимы в объемном анализе. В этих реакциях пригодны только некоторые реакции, удовлетворяющие определенным условиям. Реакция должна протекать строго по уравнению и без побочных процессов. Образующийся осадок должен быть практически нерастворимым и выпадать достаточно быстро, без образования пересыщенных растворов. К тому же необходимо иметь возможность определять конечную точку титрования с помощью индикатора. Наконец, явления адсорбции (соосаждения) должны быть выражены при титровании настолько слабо, чтобы результат определения не искажался.
Аргентометрия - объемный аналитический
метод, основанный на реакциях осаждения ионов галогенов катионами серебра с
образованием малорастворимых галогенидов:
Cl- + Ag+ = AgCl↓
Наиболее
распространено аргентометрическое определение хлора по методу Мора. Сущность его состоит в прямом титровании жидкости
раствором нитрата серебра с индикатором хроматом калия до побурения осадка.
Индикатор метода Мора - раствор К2СгО4
дает с нитратом серебра красный осадок хромата серебра Ag2CrO4, но
растворимость осадка (6,2ּ10-3 моль/л) гораздо больше
растворимости хлорида серебра (1,33ּ10-5 моль/л). Поэтому при
титровании раствором нитрата серебра в присутствии хромата калия красный осадок
хромата серебра появляется лишь после добавления избытка ионов Ag+,
когда все хлорид-ионы уже осаждены. При этом всегда к анализируемой жидкости
приливают раствор нитрата серебра, а не наоборот.
Возможности применения аргентометрии
довольно ограничены. Её используют только при титровании нейтральных или
слабощелочных растворов (рН от 6,5 до 10,5).
Качественное определение Сl-.
В
колориметрическую пробирку наливают 5 мл воды и добавляют три капли раствора
нитрата серебра с массовой долей 10 %. Примерное содержание хлор-иона
определяют по осадку или мути в соответствии с требованиями таблицы 1.
Таблица 1 – Качественное определение
содержания Сl- в воде
|
Характеристика
осадка или мути |
Содержание
Сl-, г/л |
|
1. Опалесценция или
слабая муть |
0,001÷0,01
|
|
2. Сильная муть |
0,01÷0,05 |
|
3. Образуются хлопья,
осаждаются не сразу |
0,05÷0,1 |
|
4. Белый объемный
осадок |
Более 0,1 |
Наблюдения: При
добавлении к воде нитрата серебра наблюдается – муть, т.е. содержание хлор-иона
в воде находится в пределах 0,01÷0,05 г/л (таблица 1).
Количественное определение Сl-. Отбирают
100,0 мл испытуемой воды в коническую колбу и прибавляют 1 мл раствора хромата
калия. Одну пробу титруют раствором нитрата серебра до появления слабого
оранжевого оттенка, вторую пробу используют в качестве контрольной пробы. При
значительном содержании хлоридов образуется осадок AgCl, мешающий определению.
В этом случае к оттитрованной первой пробе приливают 2-3 капли титрованного
раствора NaCl до исчезновения оранжевого оттенка, затем титруют вторую пробу,
пользуясь первой, как контрольной пробой.
Обработка результатов. Массовую
концентрацию хлор-иона (СCl-), г/л,
вычисляют по формуле:
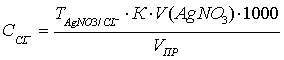
где TAgNO3/Cl- - титр AgNO3 по Сl- (количество хлор-иона, соответствующее 1 мл
раствора нитрата серебра), г/мл;
К
- поправочный коэффициент к титру раствора нитрата серебра;
V(AgNO3) - количество нитрата серебра, израсходованное на
титрование,мл;
VПР - объем пробы, взятый для определения, мл.
Исходные данные: T AgNO3/Cl- = 0,0005 г/мл; К = 0,9345;
VПР = 100,0 мл; V(AgNO3) =
2,79 мл
Таблица 2 – Расход
AgNO3 на титрование
|
№ пробы |
1 |
2 |
3 |
Среднее
значение |
|
V(AgNO3), мл |
2,80 |
2,78 |
2,80 |
2,79 |
Расчет:
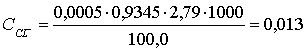 г/л.
г/л.
Заключение. Определения хлор-ионов
основаны на реакциях осаждения. Изменения концентрации и формы нахождения
хлор-ионов вызывает изменение свойств системы, которые регистрируются как
аналитический сигнал.
В
данной работе используется аргентометрическое
определение хлор-иона по методу Мора. При проведении качественного
определения установили, что содержание хлор-иона в воде находится в пределах
0,01÷0,05 г/л. Следовательно, по ГОСТ 4245 при содержании хлор-иона от
0,01 г/л и выше титрование проводят нитратом серебра в присутствии хромата
калия в качестве индикатора.
По нормативам содержание хлоридов (Сl-) в питьевой
воде не должно превышать 0,35 г/л. Проведя анализы и обработав результаты,
установили, что содержание хлор-иона в питьевой воде 0,013 г/л, что
соответствует нормам ГОСТа.