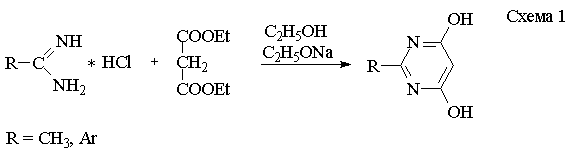Е.В.
Федорова, Е.В. Куваева, Г.В Ксенофонтова, М.В. Сопова, В.В. Зайцев,
А.С.
Сибирякова
Санкт-Петербургская
государственная химико-фармацевтическая академия
Кафедра
органической химии
Амидины в синтезе пиримидин-4,6-дионов
Значение полигидроксипиримидинов в химии лекарственных и физиологически
активных соединений, молекулярной биологии, фармакологии и фармации трудно
переоценить. Хорошо известны такие препараты как фторурацил, фторофур,
зидовудин, 6-метилурацил и др. Особую группу лекарств составляют производные
гидроксипиримидинов, обладающих снотворным, обезболивающим действием,
проявляющих антиатеросклеротический, гипотензивный, антидиабетический эффекты.
Один из основных методов получения пиримидинов основан на конденсации
амидинов (мочевин) с β-дикарбонильными соединениями (конденсация типа
[3+3]) [1].
Для синтеза 2-замещенных-4,6-дигидроксипиримидинов в качестве исходных
соединений используются гидрохлориды амидинов и малоновый эфир. Конденсацию
ведут в абсолютном этиловом спирте в присутствии этилата натрия при
перемешивании в течение 48 часов (схема 1).
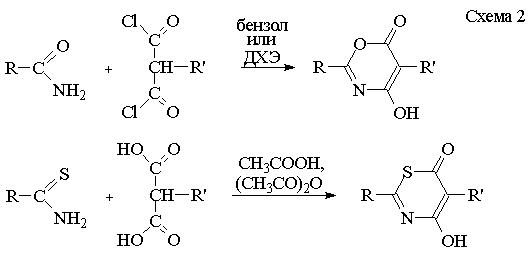
Однако, получить таким образом N-арил-4,6-дигидроксипиримидины не удалось.
Известно, что в синтезе других азинов (оксазинов и тиазинов) в качестве
ацилирующих реагентов применяется не малоновый эфир, а малоновая кислота и
малонилдихлорид [2, 3] (схема 2).
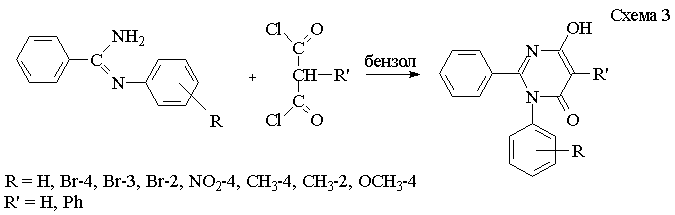
2-Замещенные-N-арил-4,6-дигидроксипиримидины
являются полными структурными аналогами оксазинов и тиазинов, в которых
отсутствует лактим-лактамная таутомерия. В связи с этим для синтеза
2-замещенных-N-арил-4,6-дигидроксипиримидинов
были выбраны соответствующие N-ариламидины и
малонилдихлориды (схема 3).
Использование в конденсации более сильного ацилирующего агента –
малонилдихлорида – привело, во-первых, к образованию целевых продуктов и
во-вторых, к значительному сокращению времени реакции.
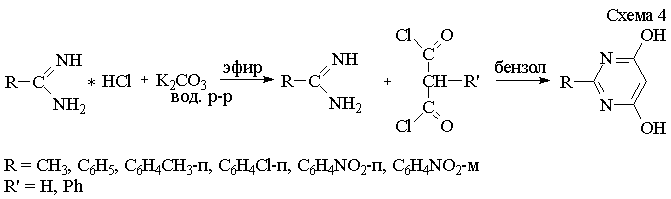
Аналогично был усовершенствован
и метод получения незамещенных 4,6-дигидроксипиримидинов. Мы выделили свободные
основания амидинов из имеющихся гидрохлоридов (схема 4). Гидрохлориды амидинов
растворяли в эфире и добавляли водный раствор поташа. Образовавшиеся два слоя –
водный и эфирный разделяли, эфирный слой сушили и упаривали, выделяя основания
амидинов. Заключительную стадию –
конденсацию амидинов с малонилдихлоридами проводили при кипячении в бензоле.
При этом окончание реакции, установленное методом ТСХ, наблюдается через 1-1,5
часа.
Строение всех синтезированных
соединений установлено и доказано с помощью УФ-,
ИК- и ЯМР 1Н, 13С, 15N-спектроскопии.
Список
используемой литературы:
[1] Pfleiderer W., Nubel E. Ann. 1960. V. 631. P. 168.
[2] Яковлев
И.П. Дисс. … доктора хим. наук. СПб. 1997.
[3] Куклин
В.Н. Дисс. … доктора фарм. наук. СПб. 1996.