Е.В.
Куваева, Е.В. Федорова, А.Г. Козьмина, И.П. Яковлев, Ю.В. Клейменова, О.В.
Морозова
Санкт-Петербургская
государственная химико-фармацевтическая академия
Кафедра
органической химии
Амидины. Синтез и строение
Амидины обладают высокой биологической активностью. Амидиновый фрагмент
(обычно в составе гетероцикла) входит в структуру многих лекарственных
препаратов, например, нафтизина, галазолина, фентоламина, хлордиазепоксида.
Часто амидины используют для синтеза гетероциклических соединений:
триазинов, пиримидинов, имидазолов и т.п.
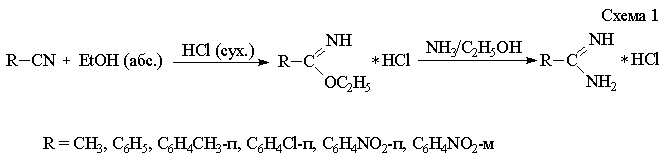
Незамещенные амидины получают общим методом синтеза из нитрилов
соответствующего строения [1] (схема 1).
Исходные
нитрилы растворяют в безводном бензоле, порциями добавляют абсолютный спирт и через
реакционную массу при охлаждении пропускают сухой HCl. Смесь оставляют на 48 часов до образования
кристаллов имидоэфиров. Полученные имидоэфиры перемешивают со спиртовым
раствором аммиака в течение 48 часов, после чего растворитель упаривают досуха.
Синтезированные
амидины представляют собой хорошо кристаллизующиеся и растворимые в воде и
спирте соли.
Попытки
выделить свободные основания под действием щелочей не всегда оказываются
успешными. Амидины, отвечающие жирным кислотам в этом состоянии неизвестны, так
как особенно легко под влиянием оснований и избытка водных кислот отщепляют
группу NH в виде NH3, фиксируя воду и переходя в соответственные
амиды. Ароматические амидины, а также N-арилзамещенные
амидины гораздо более устойчивы и существуют в свободном состоянии.
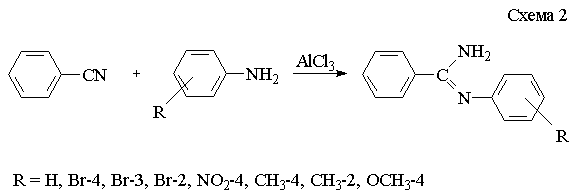
N-арилзамещенные
амидины получают взаимодействием замещенных анилинов с бензонитрилом в
присутствии катализатора безводного хлористого алюминия [2] (схема 2).
Как и
следовало ожидать, донорные заместители в кольце анилина ускоряют реакцию,
повышают выход конечных амидинов. Нитрогруппа в
о-положении настолько понижает нуклеофильность анилина, что амидин с данным
заместителем выделить не удается.
Из
литературных данных известно, что N-арилзамещенные
амидины могут существовать в двух таутомерных формах А и Б (схема 3):
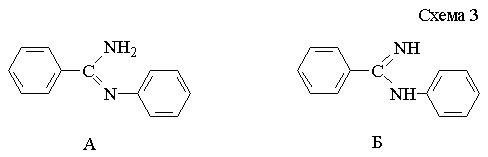
Однако,
авторы работ [2, 3] отдают предпочтение форме Б. Для превращения таутомера Б в
таутомер А используется катализатор сложного строения [4].
Нами
установлено и доказано с привлечением методов ТСХ, УФ-, ИК- и
ЯМР 1Н, 13С, 15N-спектроскопии, что синтезируемые по схеме 2 N-арил-замещенные амидины существуют в форме А.
Список
используемой литературы:
[1] Синтез
органических препаратов / Сборник 1/. 1949. 66-67.
[2] Синтез
органических препаратов / Сборник 8/. 1958. 62-64.
[3] Zhou L., Zhang. Y. Synth. Commun. 1998. 28
(17). 3249-3262.
[4] Wang J., Xu F., Cai T., Shen Q. Org. Lett. 2008. 20 (3). 445-448.