-1-
Научный прогресс на рубеже тысячелетий
Педагогические науки
и современные методы преподавания
Стариков В.С.
г.Рубежное Луганская
область
Периодическая система элементов
и к ней квантовая механика
Современную
Периодическую систему элементов Д.И.Менделеева (ПСЭ) предоставляют в учебниках
и в наглядных пособиях, где содержится: название элементов, символ элементов
большинство его ставят в цветах указывая семейственность элементов, периоды,
группы , электронную структуру, атомную массу иногда в ПСЕ указывают ряды. В
тоже время предоставляют новые варианты ПСЭ или открывая элементы всегда
указывается порядковый номер (заряд ядра), а затем к какой семейственности этот
элемент относится, то есть какой электрон в подуровне в него застраивается.
В учебнике [1] для вуза говорится
: «Вычисление вероятности нахождения электрона в данном месте атома(молекулы) и
его энергия – сложная математическая проблема. Она решается с помощью волнового
уравнения Шредингера.
Волновое уравнение Шредингера. В 1926г. Эрвин
Шредингер предложил уравнение получившие название в о л н о в о е у р а в н е н и е Ш р е д и н г е р а, которое в квантовой
механике играет такую же роль, какую закон Ньютона играет в классической
механике.»
-2-
В учебнике [2] говорится
: «Это сложное деффиринциальное уравнение, которое точное решения лишь для
очень простых систем, какой например является атом водорода.»![]()
На первом и втором
форзаце в учебниках [1] , [2] находятся короткая и длиннопериодная форма ПСЕ,
где водород помещен как в первую так и во вторую группу первого периода.
Как же здесь понимать
вероятность нахождения электрона от ядра и почему не применили уравнение
Шредингера , если оно имеет точное решение.
Такое расположение
водорода в ПСЭ говорит, что электроны все одинаковы хотя их располагают по
группам и еще о том, что они одинаковы в ПСЭ дают перескок электронов или
группируют в одну группу,как в ІІІ или VIII
группу или просто в группе слово «свойства» и т.д.
В учебнике [1] мы видим
такое высказывание : «Волновая функция являющая ее решением уравнения
Шредингера называется орбиталью.»
Дальше смотрим
высказывание.
Квантовые числа. Орбиталь можно однозначно описать с помощью
набора целых чисел: Называющие квантами их
обозначают : n – главным квантовым числом, l – орбитально квантовое число, ml
– магнитно квантовое число.
В учебнике [3] встречаем
такое высказывание «Электроны, которые движутся в орбиталях близкого размера
образуют электронные слои. Электронные
слои называются также энергетические уровни.
Энергетические уровни
нумеруются от ядра : 1,2,3,4,5,6,7. Иногда их обозначают буквами соответственно
К,L,M,N,O,P,Q. Целое число обозначающее номер уровня называется главным
квантовым числом.»
-3-
Смотрим таблицу 2.1 в
этой книге [3] данные
этой таблици существуют и в других учебных книгах.
Таблица 2.1
Главное квантовое число, типы и числа орбиталей,
и максимальное число электронов на подуровнях и уровнях.
|
Энергетический
уровень n. |
Число
подуровней равно |
Орбиталь |
Число орбиталей |
Максимальное число электронов |
||
|
в подуровне |
в
уровне равно n. |
на подуровне |
на
уровне |
|||
|
K(n=1) |
1 |
1s |
1 |
1 |
2 |
2 |
|
L(n=2) |
2 |
2s 2p |
1 3 |
4 |
2 6 |
8 |
|
M(n=3) |
3 |
3s 3p
3d |
1 3 5 |
9 |
2 6 10 |
18 |
|
N(n=4) |
4 |
4s 4p
4d
4f |
1 3 5 7 |
16 |
2 6 10 14 |
32 |
Сравнивая эти показатели
этой таблицы 2.1 с ПСЭ и расположение электронов на уровне имеется не
совпадение в энергетическом уровне – n(период) [1] начиная с третього периода.
Это
можно более подробнее увидеть в [4], [5], [6], где классическая формула 2n2
уже в
III периоде не работает, то есть в таблице 2.1 главное
квантовое число n .
Смотрим заселенность
орбиталей [7] « Все экспериментальные данные подтверждают такое предложение.
Подобно этому анализируя спектральные данные мы определяем максимальную
заселенность каждым орбитам отрицательным зарядом в таблице 3.2
-4-
Допустимое число
электронных зарядов на атомных орбиталях Таблица 3.2
|
Тип
орбиталей |
s |
p |
d |
f |
g |
h |
i |
j |
|
Максимальное
число отрицательных зарядов |
2 |
6 |
10 |
14 |
18 |
22 |
26 |
30 |
Из этой таблицы 3.2 можно
сказать все типы орбиталей начинаются с
1 и завершаются максимальным числом.
Рассмотрим малые периоды
относительно типа орбиталей.
В первом периоде S –
орбиталь максимальное число равно 2.
Во втором и третьем периоде электроны
застраиваются с 1-го по 8-ой в учебниках объясняется, что первые 2 электрона
относятся к S- это максимальное число 2 , остальные к P – это максимальное
число равно 6. В пособие по химии для поступающих в вуз [8] говорится в : «§2.8 – Теоретическое обоснование
периодической системы элементов Д.И. Менделеева.
…инертный газ аргон(z=18), 3s и 3p
– подуровни
которого полностью заполнены, электронная формула аргона : 1s22s22p63s23p6.»
Резюме : малые периоды в ПСЭ
выполнили таблицу 3.2
Приступим к большим
периодам
Рассмотрение больших
периодов мы произведем в таком порядке.
-5-
1)Обратим внимание на
первые 2 элемента, где одна S- орбиталь
содержит максимальное число 2 .
2)На
последние 8 (восемь) элементов где участвует инертный газ. Все инертные газы
завершаються орбиталью p6 .
Получается что в больших периодах
последние 8 элементов в периоде содержит еще вторую s орбиталь –
с максимальным числом 2, и 6 элементов с орбиталью максимальное число 6. Отсюда
выходит что таблица 3.2 не соответствует ПСЭ так как в ней имеется одна s- орбиталь с
максимальным числом равным 2, а в больших периодах содержится 2s – орбиталь с максимальными числами по 2.
Вот откуда идет путаница
с d – орбиталью, то есть написанию в ПСЭ в
последнем ряду в больших
периодах d10 . В одной ПСЭ в последнем ряду пишут d10 ,в
другой ПСЭ в последнем ряду не пишут d10 то есть не могут прийти
к точному решению.
Ведь необходимо обратить
внимание почему Н.Бор в своей ПСЭ (лестничная форма) d-элементы
выделил в рамке и их было 8. В тоже время Д.И.Менделеев создал VIII
групп и до сих пор идет не объяснение
этого явления.
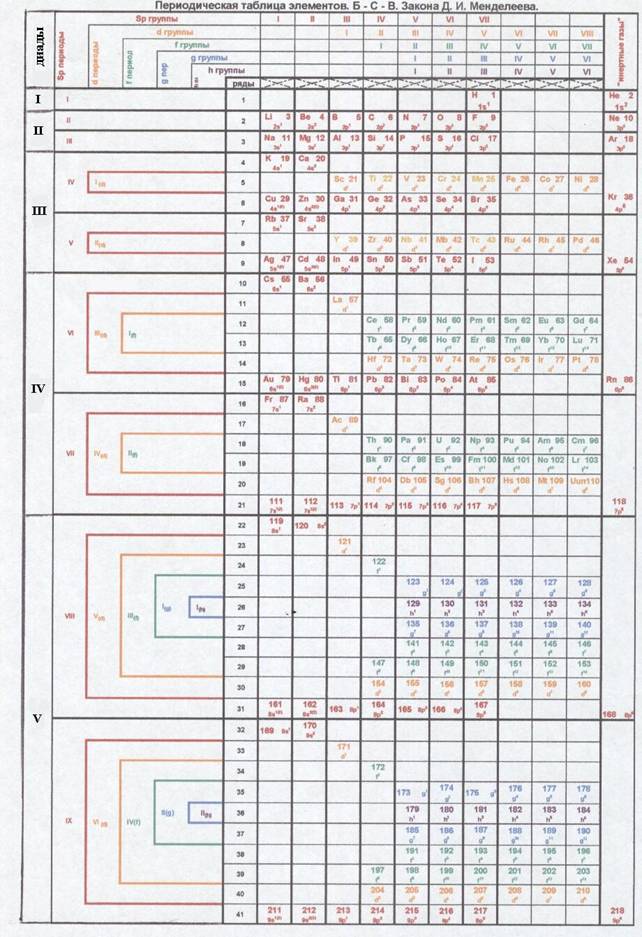
В «Периодической таблице
элементов. Бог силен во Ввселенной. Закона Д.И. Менденлеева» (ПТЭБСВЗМ) смотри
приложение 1, дает последовательное заполнение элементов, поэтому видно недостатки в других периодических
системах. В тоже время дает прогноз расположения элементов в таблице с
указанием семейственности, застройки электронов в порядковом номере, к какой
группе, периоду и ряду относится.
-6-
Распределение
электронов
в элементах с f- орбиталью и их заполнение в
периодах.
Таблица 4
|
Тип
орбитали |
f |
f |
f |
f |
f |
f |
f |
f |
f |
f |
f |
f |
f |
f |
|
|
Порядковый номер электрона |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
|
В ПТЭБСВЗМ |
Лантаноиды |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
|
Актиноиды |
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
|
|
VIII Период |
122 |
141 |
142 |
143 |
144 |
145 |
146 |
147 |
148 |
149 |
150 |
151 |
152 |
153 |
|
|
В ПСЭ 1998 [10] |
Лантаноиды |
|
58 |
59 |
60 |
61 |
62 |
63 64 |
|
65 |
66 |
67 |
68 |
69 |
70 71 |
|
Актиноиды |
|
91 |
92 |
93 |
|
94 |
95 96 |
|
97 |
98 |
99 |
100 |
101 |
102 103 |
|
|
VIII
Период |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В ПСЭ 1988
[9] |
Лантаноиды |
58 |
|
59 |
60 |
61 |
62 |
63 64 |
|
65 |
66 |
67 |
68 |
69 |
70 |
|
Актиноиды |
|
91 |
92 |
93 |
|
94 |
95 96 |
97 |
|
98 |
99 |
100 |
101 |
102 |
|
|
VIII
Период |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Из таблицы 4 можно
видеть, что в ПТЭБСВЗМ f – орбиталь одинаково
заполняется как в VI ,так и в VII
VIII, в периодах то есть по 14
f элементов. В ПСЭ различных изданий имеется один и тот же
электрон застраивающийся в двух порядковых номерах элемента. Также таблица 4
показывает,что из 14 максимального числа, то есть из 14 электронов есть
электроны которые не имеют порядковых номеров, также можем увидеть что
порядковые номера №71 и №103 относятся к d орбитали.
-7-
Таблица 5
Распределение электронов в
элементах с d-орбиталью и их заполнениями.
|
Тип
орбитали |
d |
d |
d |
d |
d |
d |
d |
d |
d |
d |
d |
|
|
Порядковый номер электрона |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
В ПТЭБСВЗМ |
IV Период |
|
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
|
|
V Период |
|
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
|
|
|
|
VI Период |
|
57 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
|
|
|
|
VII Период |
|
89 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
|
|
|
|
VIII Период |
|
121 |
154 |
155 |
156 |
157 |
158 |
159 |
160 |
|
|
|
|
В ПСЭ 1998 [10] |
IV Период |
|
21 |
22 |
23 |
|
24 25 |
26 |
27 |
28 |
|
29 |
|
V Период |
|
39 |
40 |
|
41 |
42 43 |
|
44 |
45 |
|
46 |
|
|
VI Период |
58 |
57 |
72 |
73 |
74 |
75 |
76 |
77 |
|
78 |
79 |
|
|
VII
Период |
94 |
89 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
|
|
|
|
В ПСЭ 1988
[9] |
IV Период |
|
21 |
22 |
23 |
|
24 25 |
26 |
27 |
28 |
|
29 |
|
V Период |
|
39 |
40 |
|
41 |
42 43 |
|
44 |
45 |
|
46 |
|
|
VI Период |
|
57 71 |
72 |
73 |
74 |
75 |
76 |
77 |
|
78 |
79 |
|
|
VII
Период |
|
89 103 |
104 |
105 |
106 |
107 |
|
|
|
|
|
|
Таблица
5 показывает что в ПТЭБСВЗМ d-орбиталь заполняется
стабильно как в IV, V, VI, VII,
VIII периодах,но в ПСЭ разных изданий не только отличаются, но и
существует то, что один и тотже электрон размещен в разных порядковых номерах,
а также из максимального числа 10 в d – орбитали
есть электроны которые не получают порядкового номера.
В источнике [4] мы можем увидеть, как
выглядит кривая при заполнении d – орбитали
то есть l – орбитально квантовое число.
Такое
заполнение в ПСЄ с s-,d- и f- орбиталями
приводит к тому что
расчеты квантовой механики не могут соответствовать правильному решению.
-8-
Теперь внимательно
вдумаемся в такие слова [8] «Именно в этом смысле
говорят о слоистой структуре электронной оболочки атома, подразумевая при этом
под понятием слоя электронной оболочки совокупность электронов обладающих
одинаковым квантовым числом.»
Обратим
внимание на выше сказанное: «…о слоистной структуре электронной оболочки
атомов. Когда же посмотрим на предлогаемую «Периодическую таблицу элементов. Бог силен во
вселенной. Закона Д.И.Менделеева.» мы видим что в больших периодах хорошо видна
слоистность элементов например : в VIII периоде имеется 22-31
рядах s,p
-элементы в 29,30 рядах d-
элементы в 24,28,29 рядах f- элементы, в 25,27
рядах g-элементы, в 26 ряду h – элементы, в тоже
время имеется слоистность в структуре размещения электронов атома, это
расстановка по группам, где предоставляется группа каждой семейственности.
Таким образом
горизонтальный показатель это ряд, а вертикальный показатель это группа –
получается клетка-место, где должен находится элемент и там же указывается
какой застраивается электрон.
Данная предлагаемая
таблица построена на простых законах и правилах взята из природы.
Например: взяты
планетарные построения. Второе, движение электрона рассматривалось, что простой
дождевой червь не может двигаться по пути другого дождевого червя так как там –
на этом пути – питания для него не будет, а будут его отходы, отходы в которых
нуждаются другие виды , но не виды дождевого червя.
В учебниках не
указывается, что электроны все различны и они находятся на различных линиях
движения. В тоже время повторяемость периодов не объясняется и не объединяется
в диады, как это делается в природе.
-9-
В материалах конференции
[11] нами предоставлялась контрольная
« Электронно – периодическая таблица для инертных газов» по которой
контролируется сколько элементов в периоде и каким элементов будет заканчиваться
период а также какая будет у него электронная структура но главное то , что при
построении предлагаемого варианта придерживались к такому правилу « Мир
интересен тем что он разнообразен от бесконечно малой величины до бесконечно
большой и нужно знать, где остановиться их рассматривать о начале и конце этих
величин, «…диады, периоды, ряды,
группы, заряд ядра, электроны, частицы, …» Об этих материях в частицах знает
Бог. Зная количество материи в единице (порция – квант) за единицу может
браться «Божественная частица» поэтому водород и поставлен не в I
группу а в VII группу, вот эта причина и
дала написать в
названии предлагаемой таблице «Бог силен во Вселенной».
Многие ученые стараются
предложить убрать эти слова в названии, но они были написаны еще в 50-ых годах
прошлого столетия, когда не признавали Бога, а сейчас даже президенты принимая
присягу дают клятву ложа одну руку на сердце а другую на Божественную книгу, и
говорят «… да поможет Бог».
В настоящее время
объединились ученые и работают на большом адронном коллайдере, стараются
открыть «Частицу Бога» которую – теоретически предсказал Петер Хиггсон в
1960-1964 году, но предлагаемая ПТЭБСВЗМ построена в 50-ых годах прошлого
столетия, где учитывались «частицы Бога»
поэтому оставлены пустые клетки перед водородом и в тоже время «частицы
Бога» дали разнообразие семейственности даже неизвестным элементам . Смотри приложение 1.
-10-
Литература :
1. Н.С. Ахметов Общая
неорганическая химия М.Высшая школа 1981.
2. В.В. Фролов Химия.
М.Высшая школа 1975.
3. Г.П. Химченко Пособие по
химии. Для поступления в вузы.Москва новая волна 2006.
4. Стариков В.С.
Периодическая таблица надстраивается и улучшается в изучении//Наука і Освіта. 2003. Матеріали международной
наукові – практічной конференціЇ «Наука і Освіта 2003.»
Дніпропетровськ. -2003.- Т. 16. – с 42-46.
5. Стариков В.С Первичные
проблемы квантовой механики к современной Периодической системе элементов
Д.И.Менделеев «БалГРАД-БГ» ООД 2008. Материалы за 4 международно научно
практичную конференцию». «Наука пространства на Европа – 2008». – София. –
2008. Т.28 . – с.16-19.
6. Стариков В.С
Периодический закон – инновация.// Наука і освіта. 2006.
Матеріали II международної науково практичної конференції «Дні науки
-2006» - Дніпропетровськ. – 2006.-Т.15.-С.78-85.
7. Дж. Компбал Современная общая химия
М.Мир 1975.
8. Л.А. Корольков Основы неорганической химии. Пособие для учителей
М.Просвещение 1982.
9. Периодическая система элементов Д.И.Менделеева УДК 541.9(083.816) М.1986 и
1988 Изд.Химия.
10. Периодическая
система элементов Д.И.Менделеева из ученика Н.В. Романов Загально та неорганічна хімія». Киев. Ірпінь 1998р.
11. Стариков В.С.
Современное преподавание – сила науки и государства в будущем// Наука і освіта 2005 матеріали VII міжнародної науково
практичної конференції “Наука і освіта 2005г.»
.-Дніпропетровськ.-2005 год. Т.41.-С.25-28.
-11-
Приложение 1