Химия и химические технологии / 5.
к.т.н. Родионов И.В.1, асп. Бердник М.И.2,
асп. Карпова А.И.2, д.в.н. Анников В.В.2
1Саратовский
государственный технический университет
2Саратовский государственный аграрный университет им.
Н.И. Вавилова
Статья подготовлена при
поддержке гранта Президента РФ
МК-1799.2011.8.
Свойства и оценка уровня
биосовместимости ортопедических стержневых остеоимплантатов с оксидным покрытием,
полученным паротермическим оксидированием
Существенной
проблемой эффективного приживления стержневых имплантатов-остеофиксаторов,
применяемых в аппаратах внешнего остеосинтеза, является недостаточная прочность
сцепления поверхности имплантатов с окружающей костной тканью. Для обеспечения
интеграционного взаимодействия имплантатов и кости на металлической поверхности
изделия формируют пористое биосовместимое покрытие, как правило, на основе
кальцийфосфатных керамик, ситаллов, углерода и некоторых других видов
материалов с биоактивными свойствами. Однако, материалы таких покрытий являются
довольно дорогостоящими, а технологии их нанесения отличаются значительной
сложностью, что далеко не всегда позволяет эффективно использовать
разработанные технологические процессы получения биосовместимых покрытий.
Известно, что целый ряд оксидов металлов обладает высоким уровнем
биоинертности (нетоксичности), что делает принципиально возможным их применение
в качестве покрытий медицинского назначения на ортопедических стержневых
металлоимплантатах. Процессы формирования таких оксидных покрытий
характеризуются высокой технико-экономической эффективностью, т.к. не требуют
использования дополнительных материалов для получения покрытия. Создание
оксидного покрытия осуществляется путем взаимодействия металлической матрицы с
реакционной окислительной средой, представляющей водные растворы электролитов
анодирования, а также кислородосодержащие газовые среды и их смеси [1-4].
Предварительные авторские исследования показали, что наиболее эффективным
способом получения оксидных биосовместимых покрытий на имплантатах из титана и
его сплавов является термооксидирование в среде перегретого водяного пара [5].
Поэтому цель работы заключается в исследовании комплекса свойств
паротермических оксидных покрытий на титановых остеоимплантатах и оценке их
влияния на биосовместимость поверхности.
Методика исследования
Образцами служили пластины с площадью рабочей поверхности 200 мм2,
изготовленные из биоинертного технического титана ВТ1-00, содержащего до 0,4%
примесей, в том числе 0,12% железа как металлическую примесь. Перед паротермическим
оксидированием поверхность образцов и опытных стержневых остеоимплантатов
подвергалась подготовке путем ультразвукового обезжиривания в моющем растворе,
промывки и сушки, а также обдувки струей порошкового корунда Al2O3. Благодаря этому
обеспечивалась высокая степень очистки поверхности с созданием исходной
выраженной микрошероховатости для получения пористого и адгезионно-прочного
термооксидного покрытия.
Последующее оксидирование пескоструйно-обработанных титановых образцов и стержневых имплантатов проводилось в печи экспериментальной нагревательной установки при различных режимах, включающих температуру нагрева 450 и 5500С в атмосфере перегретого водяного пара, а также продолжительность оксидирования 1, 2, 3 ч при каждой температуре. Выбранный температурный режим оксидирования позволял избежать образование в покрытии хрупких титанонитридов, активно возникающих при температурах свыше 6000С.
1.Фазовый состав паротермического оксидного покрытия изучался методом рентгенофазового
анализа с помощью дифрактометра ДРОН-4, снабженного рентгеновской трубкой с
медным анодом, в CuKα-излучении при сканировании брэгговского угла со скоростью
2 град/мин. Идентификация фаз на получаемых дифрактограммах производилась по
картотеке JCPOS (1985 г.).
2.Толщина получаемых покрытий определялась с помощью оптической микроскопии на
специально приготовленных микрошлифах по стандартной методике. Измерения проводили
с использованием микроскопа МИМ-7, имеющего окуляр с размерной микрометрической
шкалой, при увеличении 190 крат.
3. Шероховатость
оксидных покрытий получаемых образцов исследовалась профилометрическим методом
измерения параметров микронеровностей Rа, Rz,
Rmax, Rр, Sm по шестидесяти
базовым линиям с последующей математической обработкой результатов измерений.
Оборудованием для исследования шероховатости служил микропроцессорный
профилограф-профилометр «Калибр-171011».
4. Морфологические характеристики оксидных покрытий изучались методом бесконтактного
определения размерных параметров выступающих частиц и имеющихся углублений,
включая поры. Для таких измерений и обработки их результатов использовались анализатор
изображений микроструктур АГПМ-6М с микроскопом «Биолам» и специальная
компьютерная программа PlotCalc.
5. Коррозионная активность термооксидированного титана оценивалась по величине его бестокового электродного потенциала Екорр в физиологическом растворе, моделирующем состав плазмы крови и тканевой жидкости. Температура раствора изменялась и составляла значения 25, 30, 35, 40, 450С, что моделировало область нормальной температуры организма с выходом за ее пределы для возможности установления температурной зависимости потенциала.
6. Микротвердость оксидного покрытия рассматривалась как эквивалент его прочности и измерялась на специально приготовленных микрошлифах образцов с косым срезом. Измерение производилось с помощью прибора ПМТ-3, нагрузка на индентор применялась равной 50 г.
7. Адгезия покрытий исследовалась методом нормального отрыва с помощью разрывной машины ИР-5046-5.
Результаты исследования и их анализ
1. Фазовый состав изучался у оксидного покрытия, полученного при наибольших значениях температуры и продолжительности паротермического оксидирования – t = 5500С, τ = 3 ч, что повышало вероятность образования в покрытии оксидов и других соединений как титана, так и примеси железа. Дифрактограмма, полученная в итоге рентгенофазового анализа, и результаты ее обработки показали, что значения межплоскостного расстояния d при различной величине интенсивности дифракционных линий J соответствовали присутствию в покрытии наибольшего количества фаз титана и его нестехиометрического диоксида TiO2 с наличием весьма малого содержания низших оксидов Ti2O3 и Ti3O5 (рис.1).
Рис. 1. Дифрактограмма оксидного
покрытия, полученного паротермическим оксидированием при
t =
5500С и τ = 3 ч
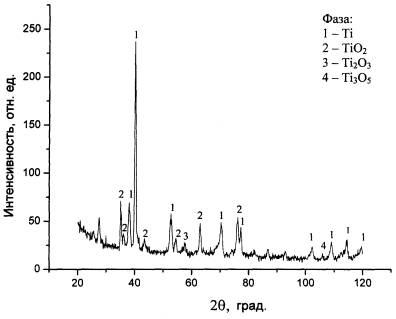
При фазовом анализе не было обнаружено
присутствия нитридов титана, а также оксидов и нитридов железа, обладающих
высокой хрупкостью и сильно снижающих прочность покрытия. Более низкие значения
температуры и продолжительности оксидирования приблизили бы к нулю содержание
низших оксидов и вероятность образования нитридов титана. Полученные данные
позволяют считать, что принятые режимы паротермического оксидирования
обеспечивают формирование оксидного покрытия, состоящего преимущественно из
диоксида TiO2.
2. Толщина. Оптико-микроскопическое измерение толщины h покрытий на микрошлифах плоских оксидированных образцов-свидетелей и сравнительная оценка ее значений в зависимости от режима обработки показывают, что при t = 4500С и τ = 1, 2, 3 ч толщина увеличивается в пределах 4-6 мкм через каждый час окисления и составляет величину порядка h = 20 мкм при наибольшей продолжительности, равной τ = 3 ч. Таким образом, относительно невысокая температура оксидирования титана в окислительной атмосфере с недостатком кислорода не обеспечивает активного образования оксидов и интенсивного роста покрытия в толщину даже при значительной продолжительности паротермической обработки.
Возрастание температуры до 5500С
существенно ускоряет протекание физико-химических реакций и скорость процесса
окисления титановой поверхности с формированием толщины покрытия на уровне h =
25 мкм – при τ = 1 ч, h =
34 мкм – при τ = 2 ч, h = 45 мкм – при τ = 3
ч. Данные значения толщины покрытий являются более благоприятными для
обеспечения требуемых условий механической совместимости оксидированных имплантатов
с костной тканью и их эффективного функционирования.
Исходя из полученных результатов можно
полагать, что температура 5500С, продолжительность 2 и 3 ч
способствуют созданию покрытия имплантатов с необходимой для их нормального
биомеханического взаимодействия толщиной, что характеризует эффективность
применения паротермического оксидирования при выбранных режимах.
3. Шероховатость. Профилометрическое
измерение шероховатости исходной пескоструйно-обработанной поверхности
показало, что величина параметров профиля соответствует значениям Rа
= 0,84 мкм, Rz = 2,80 мкм, Rmax = 4,00
мкм, Rр = 2,10 мкм и Sm = 8,30 мкм. В
процессе последующего паротермического оксидирования такой поверхности при
температуре t = 4500С и продолжительности τ = 1 ч
происходит некоторое повышение шероховатости с увеличением параметров высоты Rа,
Rz, Rmax, Rр и небольшим
уменьшением величины шага неровностей Sm. При τ = 2 ч
значения параметров Rа, Rz, Rmax,
Rр несколько снижаются, шаг местных выступов Sm
увеличивается, что обусловлено преимущественным окислением донных частей
микровпадин и общим сглаживанием профиля покрытия. При τ = 3 ч происходит
некоторое возрастание толщины покрытия, что приводит к образованию в нем
повышенного количества различных микронеровностей и соответствующему увеличению
уровня шероховатости.
Подобная кинетика изменения параметров
микрорельефа оксидного покрытия характерна и для оксидирования при значениях t = 5500С, τ =
1, 2, 3 ч. Так, при τ = 1 ч шероховатость
покрытия возрастает по сравнению с исходной
пескоструйно-обработанной поверхностью, при τ = 2 ч она практически не изменяется,
а при τ = 3 ч шероховатость значительно увеличивается.
 Анализ полученных результатов дает основания
полагать, что паротермическое оксидирование титана обусловлено трехстадийным
процессом роста толщины покрытия с различным характером окисления микровыступов
и впадин: I стадия – равномерное окисление неровностей
поверхности и пропорциональный рост параметров шероховатости в течение 1-го
часа; II стадия – преимущественное окисление микровпадин,
создающее увеличение шага неровностей, снижение параметров высоты, а также
выравнивание профиля в течение 2-го часа; III стадия – интенсивный
рост толщины покрытия, образование его выраженной поверхностной микроструктуры
и развитого рельефа в течение 3-го часа (рис.2).
Анализ полученных результатов дает основания
полагать, что паротермическое оксидирование титана обусловлено трехстадийным
процессом роста толщины покрытия с различным характером окисления микровыступов
и впадин: I стадия – равномерное окисление неровностей
поверхности и пропорциональный рост параметров шероховатости в течение 1-го
часа; II стадия – преимущественное окисление микровпадин,
создающее увеличение шага неровностей, снижение параметров высоты, а также
выравнивание профиля в течение 2-го часа; III стадия – интенсивный
рост толщины покрытия, образование его выраженной поверхностной микроструктуры
и развитого рельефа в течение 3-го часа (рис.2).
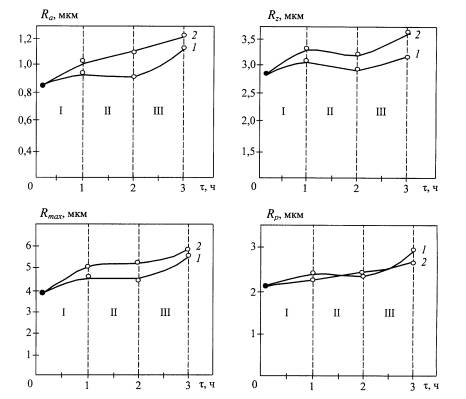
Рис. 2. Влияние режима
оксидирования на изменение параметров шероховатости оксидного покрытия: кривая 1
– t = 4500С, кривая 2 – t = 5500С; I – равномерное окисление
микронеровностей, II – преимущественное окисление микровпадин, III
– образование пористой структуры и развитого рельефа покрытия (точка ● –
значения параметров пескоструйно-обработанной поверхности)
Анализ
и оценка результатов исследования показывают, что наибольшие значения
параметров шероховатости паротермического оксидного покрытия обеспечиваются при
повышенной продолжительности оксидирования, способствующей росту толщины покрытия
и развитию микрорельефа поверхности.
По приведенным основаниям следует считать, что
необходимый для создания высокой остеоинтеграционной способности имплантатов
микрорельеф получается в процессе формирования оксидного покрытия при t=5500С и
τ=3 ч.
4. Морфология. Исследование структурных элементов оксидированной поверхности показало, что формирование оксидных покрытий на титане существенно зависит от температуры и продолжительности оксидирования. Так, при температурах 450 и 5500С повышение продолжительности оксидирования от 1 до 2 ч создает значительное увеличение радиуса частиц при снижении радиуса пор и величины пористости. Оксидирование в течение 3 ч при тех же температурах приводит к некоторому уменьшению радиуса частиц, вызывает рост радиуса пор и открытой пористости (рис.3,4).
Анализ полученных результатов позволяет
считать, что рост продолжительности оксидирования от 1 до 2 ч создает более
интенсивное окисление микровпадин, чем снижает размер пор. За счет этого
увеличивается площадь поверхности между порами, происходит сглаживание
микрорельефа и повышается структурно-морфологическая однородность оксидного
покрытия.
Оксидирование в течение 3 ч при тех же температурах значительно повышает толщину покрытия с появлением внутренних напряжений, превышающих предел его прочности. Из-за этого в покрытии образуются микротрещины с формированием крупных пор и увеличением морфологической гетерогенности. Это придает оксидному покрытию качества биоактивности и улучшает его остеоинтеграционные способности.
Исходя из полученных результатов,
можно заключить, что необходимая для нормального биомеханического
взаимодействия покрытия с костной тканью морфология образуется в процессе
паротермического оксидирования титана при температуре 5500С и
продолжительности 3 ч. За счет этого указанный режим может создать наиболее
благоприятные условия для получения оксидного покрытия стержневых имплантатов с
остеинтеграционными качествами поверхности.
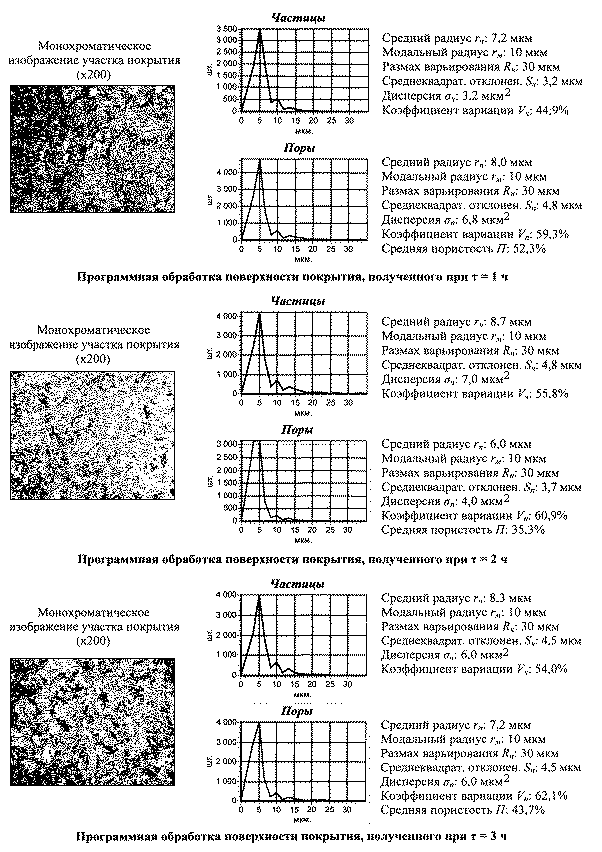
Рис. 3. Параметры
морфологии оксидного покрытия, полученного
при t = 4500С и τ = 1, 2, 3 ч
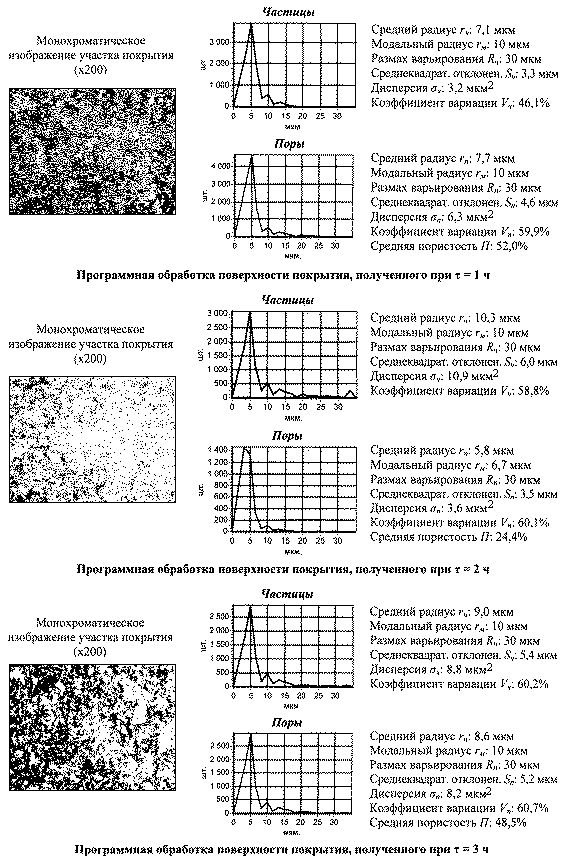
Рис. 4. Параметры
морфологии оксидного покрытия, полученного
при t = 5500С и τ = 1, 2, 3 ч
5. Коррозионная активность покрытий характеризовалась положительными значениями их электродных потенциалов Екорр при всех принятых режимах оксидирования и температурах физиологического раствора (табл.). Это указывает на устойчивость покрытия и его сопротивляемость коррозии в растворе, моделирующем состав плазмы крови и тканевой жидкости.
Температура оксидирования 4500С с продолжительностью 1 и 2 ч придавала покрытию величину потенциала, мало зависящую от нагрева коррозионного раствора и находящуюся в пределах 0,103…0,124 В. Увеличение продолжительности оксидирования до 3 ч приводило к некоторому повышению потенциала до уровня 0,121…0,136 В.
Таблица
Коррозионные потенциалы паротермических
оксидных покрытий титана,
полученных при различных режимах
оксидирования
|
Температура паротермического оксидирования t, 0С |
Продолжительность оксидирования τ, ч |
t, 0С модельного раствора |
||||
|
25 |
30 |
35 |
40 |
45 |
||
|
Екорр покрытия, мВ (н.х.с.э) |
||||||
|
450 |
1 |
109 |
106 |
103 |
104 |
113 |
|
2 |
108 |
111 |
110 |
124 |
121 |
|
|
3 |
130 |
136 |
134 |
121 |
122 |
|
|
550 |
1 |
118 |
133 |
136 |
133 |
130 |
|
2 |
313 |
268 |
250 |
189 |
178 |
|
|
3 |
57 |
65 |
65 |
62 |
62 |
|
Температура оксидирования 5500С с продолжительностью 1 ч обусловливала величину потенциалов, соответствующую уровню потенциалов покрытия, полученного при температуре 4500С и продолжительности 3 ч. С повышением продолжительности оксидирования до 2 ч наблюдалась сильная зависимость потенциала от нагрева раствора. Так, рост температуры физиологического раствора от 25 до 450С вызывал почти двукратное снижение потенциала покрытия – от 0,313 В до 0,178 В. Продолжительность оксидирования в течение 3 ч приводила к образованию наиболее низких значений потенциала покрытия на уровне 0,057…0,065 В.
Данные результаты характеризуют сильную зависимость коррозионного потенциала оксидного покрытия от режима паротермического оксидирования, при этом наибольшее влияние оказывает температура оксидирования. Материалы ранее проведенных коррозионных испытаний позволяют считать, что главную роль в полученной зависимости играет изменение фазово-структурного состояния покрытия, в первую очередь, морфологическая гетерогенность поверхности и степень ее пористости.
Согласно имеющимся данным с увеличением показателей микрошероховатости, уменьшением размера частиц макрорельефа и повышением пористости поверхности возрастает физическая площадь ее контакта с модельным раствором, увеличивается электрохимическая гетерогенность. При этом донная часть возникающих трещин, пор, углублений отличается более отрицательным потенциалом по сравнению с их стенками. В указанных условиях термодинамическая устойчивость поверхности снижается при уменьшении ее коррозионного потенциала и повышении склонности к коррозии.
При температуре оксидирования 4500С в течение 1 и 2 ч невысокая скорость реакционной диффузии атомов титана и кислорода создает небольшое различие в размерах морфологических частиц, пор и степени пористости получаемых покрытий, что сближает значения их потенциалов (табл.). Повышение продолжительности оксидирования до 3 ч заметно увеличивает толщину покрытия и сглаживает макрорельеф поверхности, повышая ее склонность к пассивации и величину электродного потенциала.
При температуре 5500С и продолжительности 2 ч размер макрочастиц на поверхности покрытия значительно повышается, а пористость уменьшается, что увеличивает термодинамическую устойчивость и значение электродного потенциала. Сильное падение потенциала при увеличении нагрева раствора может быть связано с ростом активности его ионов, для продвижения которых вглубь данная структура оказывает наименьшее сопротивление.
Увеличение продолжительности оксидирования до 3 ч создает повышенную толщину покрытия с возрастанием его внутренних напряжений. Это вызывает значительный рост размера трещин, пор и степени пористости, снижая величину потенциала поверхности от 0,240 В до 0,064 В при температуре раствора, соответствующей норме для организма. Данное снижение потенциала свидетельствует об уменьшение электрохимического сопротивления покрытия протеканию коррозионных процессов.
Полученные результаты исследования и их анализ
позволяют рекомендовать применение паротермического оксидирования при
температуре 5500С в течение 2 ч для получения структурно
гетерогенного оксидного покрытия на титановых остеоимплантатах длительного
функционирования (6-9 месяцев) с наилучшим уровнем коррозионной стойкости при
взаимодействии с окружающей биосредой. Для
ортопедических имплантатов более короткого функционирования (4-6 недель)
более целесообразным является режим оксидирования при температуре 5500С
и продолжительности 3 ч за счет чего создается структурное состояние покрытия с
увеличенной пористостью и высоким уровнем шероховатости, обеспечивающих
формирование повышенных качеств биосовместимости.
6. Микротвердость покрытия существенно изменялась в зависимости от температуры и продолжительности оксидирования. При этом рост температуры с 450 до 5500С и повышение продолжительности от 1 до 2 ч создавали одинаковое наибольшее увеличение микротвердости с 6,6 до 8,3 ГПа. Данное возрастание твердости объясняется установленным снижением пористости покрытия, а также измельчением зерен его структуры под влиянием роста толщины и внутренних напряжений. При оксидировании в течение 3 ч внутренние напряжения в покрытии превышают предел его прочности, что вызывает растрескивание покрытия и уменьшение его твердости до 6,1-6,8 ГПа.
Увеличение расстояния от границы между покрытием и титаном приводило к наибольшему росту микротвердости от 2,8 до 7,2-8,5 ГПа в середине толщины покрытия. С приближением к поверхности твердость уменьшалась до 6,5-7,6 ГПа, что обусловлено наличием поверхностной пористости и морфологической гетерогенности.
Полученные результаты показывают, что паротермические оксидные покрытия титана, полученные при выбранных режимах обработки, обладают высоким уровнем микротвердости, обеспечивающим требуемую механическую совместимость оксидированных имплантатов с костными структурами при необходимом восприятии внешних функциональных нагрузок.
7. Адгезия. Определение величины адгезии σадг методом нормального отрыва проводилось только для покрытий, сформированных при t=5500С и τ=1, 2, 3 ч, т.к. такие покрытия характеризовались наибольшими значениями толщины и, как следствие, пониженной прочностью в сравнении с тонкослойными покрытиями, созданными при t=4500С. Данное условие позволило оценить адгезию покрытий с наибольшей склонностью к механическому разрушению, отслаиванию и отсоединению от поверхности основного металла.
Адгезиометрическое исследование показало, что сила сцепления оксидных покрытий с поверхностью титана соответствует относительно большой величине адгезии, которая составляет 40 МПа для покрытия, полученного в течение 1 ч оксидирования, 37 МПа – в течение 2 ч, 34 МПа – в течение 3 ч. Такой высокий уровень адгезии обусловлен прочной физико-механической взаимосвязью оксидных покрытий с шероховатой пескоструйно-обработанной поверхностью титана. Данная взаимосвязь обеспечивается благодаря тому, что титан, являясь высокопластичным металлом, легко микродеформируется абразивными частицами при пескоструйной обработке с образованием на поверхности выраженного микрорельефа, усиливающего механическое сцепление покрытия с металлом. Наличие поверхностных сложноориентированных микронеровностей деформированного титанового слоя приводит к созданию наиболее эффективного «якорного» механизма сцепления металла и оксидного покрытия, значительно повышающего его адгезионную прочность.
Представляется очевидным, что покрытия, полученные паротермическим оксидированием при t=4500С и τ=1, 2, 3 ч, будут отличаться несколько большей величиной адгезии, обусловленной меньшей толщиной и повышенной прочностью поверхностных титанооксидов, в наилучшей степени способствующих их сильному сцеплению с основой.
Апробация in vivo
Экспериментальные исследования биосовместимости термооксидированных титановых
остеоимплантатов, проводимые на лабораторных животных (кролики породы “черный
великан” и “нидерландская красная”), подтвердили, что при выбранных режимах
паротермического оксидирования (t=4500С,
τ=3 ч и t=5500С,
τ=1, 2, 3 ч) достигается необходимый уровень приживления имплантатов в
костных структурах и обеспечивается интеграция оксидированной поверхности с
окружающей тканью.
Отсутствие существенных воспалительных осложнений у всех экспериментальных
животных в ранний постоперационный период (7 суток), отсутствие
микроподвижности имплантатов в отдаленный период (45 суток), необходимость
применения ключа для удаления имплантатов из кости по окончании эксперимента
могут служить клиническим свидетельством наличия высокого уровня
биосовместимости и остеоинтеграционных качеств у паротермических оксидных
покрытий стержневых титановых имплантатов.
Выводы
На основании сопоставления полученных результатов экспериментальных
исследований можно заключить, что паротермическое оксидирование пескоструйно-обработанного
титана при t=4500С,
τ=3 ч и t=5500С,
τ=1, 2, 3 ч создает такие условия формирования оксидных покрытий, при
которых они приобретают физико-химические, механические и
поверхностно-структурные характеристики, благоприятствующие необходимому
интеграционному взаимодействию оксидированных титановых имплантатов с окружающей
костной тканью.
Литература
1. Родионов И.В.,
Попова С.С. Функциональные свойства анодно-оксидных покрытий, формируемых на
титановых имплантатах в растворе серной кислоты с добавкой сульфата меди //
Гальванотехника и обработка поверхности. Т.18. №4, 2010. С. 35-43.
2.
Родионов И.В. Создание
электрохимических биосовместимых покрытий на основе диоксида TiO2 методом анодирования титана
и его сплавов /
Сб. трудов XVI Междунар. научно-практ. конф. студентов, аспирантов
и молодых ученых «Современные техника и технологии». Томск: Изд-во ТПУ, 2010.
Т.2. С. 71-73.
3. Родионов И.В. Оксидирование медицинских имплантатов в комбинированной
инертно-окислительной газовой смеси //
Технологии живых систем. №3, 2010. С. 14-22.
4. Родионов И.В., Бутовский К.Г., Попова С.С. Применение методов газотермического оксидирования в производстве остеофиксаторов для травматологии и ортопедии / Сб. трудов Междунар. научно-техн. конф. «Успехи современной электротехнологии». Саратов: Изд-во СГТУ, 2009. С. 77-79.
5. Патент РФ на изобретение № 2332239. Способ получения биосовместимого покрытия на остеофиксаторах из титана / Родионов И.В., Бутовский К.Г., Бейдик О.В., Ткачева А.В. Опубл. 27.08.2008.