Ерошевская Л.А., Квач С.В., Зинченко А.И.
Институт микробиологии НАН Беларуси, Минск
Синтез
9-ß-D-арабинофуранозиладенина
с использованием рекомбинантных
бактериальных
ферментов
9-β-D-арабинофуранозиладенин (синонимы: ара-А, видарабин) – обладает широкой активностью в отношении
ДНК-содержащих вирусов, в том числе вируса герпеса, вызывающего энцефалиты,
кератиты и др. заболевания [1, 2].
Химические методы синтеза
ара-А характеризуются многостадийностью и низкими выходами [3]. Известны ферментативные
способы получения ара-А, заключающиеся в замене урацила в молекуле 1-b-D-арабинофуранозилурацила (ара-У) на аденин
при последовательном действии двух бактериальных ферментов – уридинфосфорилазы
(УРФ) и пуриннуклеозидфосфорилазы (ПНФ) Escherichia coli [4–6]. Исходные ара-У и аденин берутся в
концентрациях от 5 до 75 мМ. Процесс ведут при 60°С в 5–30 мМ фосфатном буфере
(рН 7,0). Выход ара-А на затраченный ара-У составляет 56–70%. Волуметрический
выход ара-А (выражающийся в количестве целевого продукта, получаемого с единицы
объема реакционной смеси) составляет 0,75–14 г/л.
Недостатками указанных
способов являются относительно низкий выход ара-А, что приводит к высокому
расходу дорогостоящего ара-У, составляющему 1,31–1,6 г на получение 1 г
целевого продукта, и сравнительно невысокий волуметрический выход ара-А, что
обуславливает низкую производительность единицы объема биореактора. Высокий
расход дорогостоящего сырья и низкий волуметрический выход целевого продукта
ограничивает возможность применения рассмотренных способов в условиях
промышленного производства.
Следует отметить, что в основу
всех известных способов ферментативного получения ара-А положена обратимая
реакция трансгликозилирования, что делает невозможным достижение высоких
выходов целевого продукта, если исходные субстраты берутся в эквимолярных
количествах. В некоторых известных способах [7–9] для повышения выхода ара-А в
реакционную смесь вносят избыточное (обычно 3-кратное) количество сравнительно
хорошо растворимого ара-У, что способствует сдвигу равновесия процесса в
сторону прямой реакции, однако приводит к значительному расходу исходного
нуклеозида, стоимость которого в десятки раз превышает стоимость аденина. Кроме
того, рассмотренные способы характеризуются низкими волуметрическими выходами
ара-А. Этот недостаток обусловлен тем, что процесс ведут при низких концентрациях
исходных реагентов.
В настоящей работе мы
синтезировали ара-А с помощью УЗ-лизатов клеток рекомбинантных штаммов E. coli, продуцирующих УРФ и ПНФ. Гены, кодирующие эти ферменты, были выделены
из хромосомальной ДНК E. coli с помощью ПЦР и известных праймеров. Конструирование рекомбинантных штаммов и
условия культивирования трансформантов описаны нами ранее [10].
Для
синтеза ара-А смесь ара-У (400 мМ) и аденина (200 мМ) инкубируется в 0,3 М
К-фосфатном буфере (рН 7,0) при 60°С с УРФ и ПНФ, изолированных из E. coli pUDP4 и E. coli pD10, соответственно.
Описываемый способ
описывается следующим уравнением реакции:
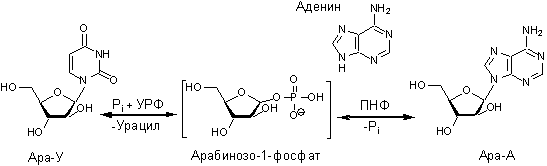
На
первой стадии процесса УРФ с участием фосфат-ионов расщепляет ара-У на урацил и
арабинозо-1-фосфат. На второй стадии ПНФ из арабинозо-1-фосфата и аденина катализирует
синтез ара-А с освобождением неорганического фосфата.
В
отличие от известных способов получения ара-А из аденина и ара-У, в
предлагаемом нами решении в реакционную смесь вносятся такие большие количества
исходных субстратов, которые ранее не применялись.
Следует
отметить, что в начале процесса большая часть аденина находится в осадке,
поскольку его насыщенный раствор при 60°С имеет концентрацию только 37 мМ. По
мере синтеза ара-А концентрация растворенного аденина снижается, что вызывает
постепенный переход аденина из осадка в раствор. Указанное отличие является
существенными, поскольку только в этом случае удается достичь повышения выхода
ара-А до 98% в расчете на затраченный ара-У и повышения волуметрического выхода
целевого продукта до 57,4 г/л.
По
нашему мнению, достигнутый результат можно объяснить следующим образом. Во-первых,
в ходе протекания первой стадии процесса после достижения урацилом в
реакционной среде концентрации 89 мМ (концентрация насыщенного раствора) он
начинает выпадать в осадок, что по закону действующих масс сдвигает равновесие
реакции в сторону более глубокого фосфоролиза ара-У, тем самым, приводя к
большему накоплению в среде арабинозо-1-фосфата – субстрата для заключительной
стадии синтеза ара-А.
Во-вторых,
по мере протекания второй стадии процесса образующийся ара-А после достижения
им концентрации 11,2 мМ (концентрация насыщенного раствора) также начинает
выпадать в осадок, что закономерно благоприятствует синтезу большего количества
этого продукта.
Литература:
1. Новые подходы к химиотерапии
герпесвирусных инфекций / Н.П. Чижов [и др.] // Антибиотики и химиотерапия. – 1993. – Т. 38, №
10/11. – С. 75–82.
2. Suzuki, M. Synergistic
antiviral activity of acyclovir and vidarabine against herpes simplex virus types 1
and 2 and varicella-zoster virus / M. Suzuki, T. Okuda, K Shiraki // Antiviral Res. – 2006. – Vol. 72, № 2. – Р. 157–161.
3.
Chattopadhyaya, J.B. A synthesis of purine arabinosides / J.B. Chattopadhyaya,
C.B. Reese // Nucleic Acids Res. – 1978. – Vol. 1. – Р. s67–s72.
4. Биотехнологический способ получения
рибавирина. Действие рибавирина и некоторых его комбинаций на репродукцию
вируса осповакцины (Vaccinia Virus) / И.Д. Константинова [и др.] // Биоорган.
химия. – 2004. – Т. 30, № 6. – С. 613–620.
5. Recombinant bacterial cells as efficient
biocatalysts for the production of nucleosides / E. Spoldi [et al.] // Nucleosides,
Nucleotides, Nucleic
Acids. – 2001. – Vol. 20, № (4–7). – P. 977–979.
6. Patent 6911341 US. Recombinant bacterial strains for the production of
natural nucleosides and modified analogues thereof / G. Bestetti, S. Cali, D. Ghisotti, G. Orsini, G. Tonon,
G. Zuffi.
7. Препаративный синтез противовирусного нуклеозида 9-b-D-аденинарабинозида с помощью бактериальных клеток / Л.А. Ерошевская [и др.] // Антибиот. мед. биотехнол. – 1986. – Т. 31, № 3. – С. 174–178.
8. Microbial synthesis of antiviral nucleosides using Escherichia coli BL21 as biocatalyst / M.C. Rogert [et al.] // Biocatal. Biotransform. – 2002. – Vol. 20, № 5. – P. 347–351.
9. Induction of nucleoside phosphorylase in Enterobacter aerogenes and enzymatic
synthesis of adenine arabinoside / X.K. Wei [et al.] // J.
Zhejiang Univ. Sci. B. – 2008. – Vol. 9, № 7. – Р. 520–526.
10. Использование микроорганизмов для синтеза фармакологически активных
нуклеозидов и нуклеотидов / С.В/ Квач [и др.] // Новейшие достижения в области
импортозамещения в химической промышленности и производстве строительных
материалов: матер. междунар. науч.-техн. конф., Мн.: БГТУ, 2009. – Ч 2. – С. 25–29.
