Бурко Д.В., Квач С.В., Зинченко А.И.
Институт микробиологии НАН Беларуси, г. Минск
Синтез
Диаденозин-5¢,5¢¢¢-P1,P4-тетрафосфата с
использованием Иммобилизованной
лизил-трнк-синтетазы
Диаденозин-5¢,5¢¢¢-P1,P4-тетрафосфат (Ар4А)
имеет важное фармакологическое значение и может стать субстанцией лекарственных
препаратов для терапии ряда заболеваний человека [1, 2]. Молекула Ар4А
содержит два аденозиновых остатка, соединенных тетрафосфатным мостиком (рис.
1).
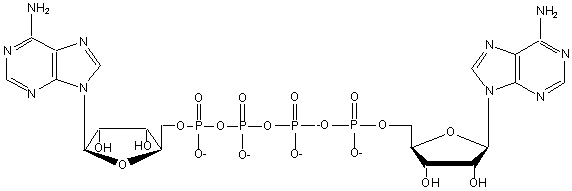
Рисунок 1. Структурная формула Ар4А
Для синтеза Ар4А
предложены многостадийные и трудоемкие химические процессы [3]. С другой
стороны известно, что синтез вышеуказанной молекулы из АТФ может осуществляться
с помощью бактериальных аминоацил-тРНК-синтетаз.
Ранее нами была
получена рекомбинантная лизил-тРНК-синтетаза Escherichia coli (LysUHis), имеющая на N-конце остаток из шести гистидинов, необходимых для аффинной
очистки белка [4]. В настоящей работе показано, что такая модификация белковой
молекулы может быть использована для иммобилизации LysUHis на аффинную смолу Ni-NTA (Qiagen, США). Полученный иммобилизованный препарат LysUHis обладает повышенной операционной стабильностью
(выдерживает 10 технологических циклов) и может использоваться для синтеза Ар4А.
Материалы
и методы. В настоящей работе был использован
рекомбинантный штамм бактерий E. сoli LysU-12, продуцирующий гомологичную LysUHis [4]. Индукцию
экспрессии рекомбинантного белка и его очистку с использованием металлоаффинной
хроматографии проводили согласно работе [5]. Препарат LysUHis после
хроматографии диализовали против 1000-кратного объема 20 мМ Трис-HCl-буфера
(рН 7,5), содержащего 0,2 мМ ЭДТА и 10% глицерина. За единицу активности фермента LysUHis принимали такое его количество, которое обеспечивало
образование 1 мкмоль Ap4A за 1 мин в соответствующих условиях реакции. Для
иммобилизации фермента к 50 мл раствора, содержащего 100 мг очищенной LysUHis (суммарная
активность 360 ед.), добавляли 20 мл смолы Ni-NTA. Суспензию
выдерживали на холоду (+4оС) в течение 2–3 ч, после чего её центрифугировали
при 5000 g в течение 3 мин. Осадок промывали несколько раз 20 мМ
Трис-HCl-буфером (рН 7,5). Полученный конъюгат смолы и
фермента ресуспедировали в равном объеме 20 мМ Трис-HCl-буфера (рН 7,5). Суспензию иммобилизованного фермента
(суммарная активность 180 ед.) хранили при +4оС.
Для синтеза Ар4А иммобилизованную
LysUHis в количестве 8,4 ед.
вносили в реакционную смесь (конечный объем 100,0 мл), содержащую (мМ): MgCl2 – 10; ZnCl2 – 0,16;
буфер MOPS-КОН (рН 7,5) – 20; АТФ – 4,3;
L-лизин – 2,4. После прибавления 100 ед. пирофосфатазы [6]
смесь инкубировали при 42оС в течение 2 ч. Затем реакционную смесь
кипятили в течение 10 мин, центрифугировали 30 мин при 20000 g, отбирали супернатант и наносили его на хроматографическую
колонку с ДЭАЭ-целлюлозой DE-32 (Whatman, Англия). Ар4А элюировали с использованием
линейного градиента бикарбоната аммония (0,5 л, от 100 до 400 мМ). Элюат упаривали
досуха на роторном испарителе при 55оС. Осадок промывали охлажденным
спиртом и высушивали под вакуумом.
Результаты
и их обсуждение. Иммобилизация LysUHis. Выделенный фермент из биомассы бактерий штамма E. coli LysU-12
был иммобилизован на смолу Ni-NTA. В результате иммобилизации со смолой связалось 60% LysUHis. При этом, не смотря на то, что общая активность
полученного препарата снизилась в 2 раза (180 ед.) по
сравнению с раствором белка (360 ед.), иммобилизация на аффинную смолу LysUHis позволила многократно (до 10 раз) использовать его
для синтеза Ар4А (рис. 2). Следует особо
подчеркнуть, что активность препарата иммобилизованной LysUHis остается неизменной в течение 1 года при
хранении при -20оС.
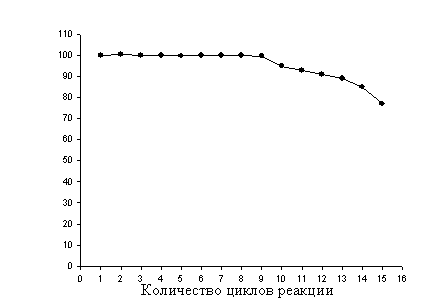
Рис. 2. Операционная
стабильность препарата LysUHis,
иммобилизованной на Ni-NTA
Выделение Ap4A. На
следующем этапе работы был проведен ферментативный синтез Ap4A. Использование двухстадийной хроматографии на колонке
с ионообменной смолой DE32 позволило
получить высокоочищенный продукт. В литературе описан способ получения данного
вещества с применением препаративной высокоэффективной жидкостной хроматографии
[7]. Однако использованный метод характеризуется сложностью и невозможностью отделения
некоторых побочных продуктов реакции. Предложенный нами метод выделения Ap4A является
недорогостоящим, достаточно простым и позволяет достичь выхода изолированного
продукта, превышающего 80%.
Заключение. Таким
образом, нами был получен препарат иммобилизованной LysUHis E.
сoli, с помощью полученного препарата фермента проведен препаративный
синтез Ар4А, выделен и очищен целевой динуклеотид.
Литература:
1. Grummt
F. Diadenosine
5',5"'-P1,P4-tetraphosphate triggers
initiation of in vitro DNA replication in baby hamster kidney cells /
PNAS. – 1978. – Vol.
75, № 1. – Р.
371–375.
2. McLennan A.G. Dinucleoside
polyphosphates—friend or foe? // Pharmacology
& Therapeutics. – 2000. – Vol. 87, № 2/3. – Р. 73–89.
3. Reiss, J., Moffat J. Dismutation
reactions of nucleoside polyphosphates. 3. The synthesis of alpha,
omega-dinucleoside 5'-polyphosphates // J.
Org. Chem. – 1965. – Vol. 30. – P. 3381–3387.
4. Бурко Д.В., Квач С.В., Зинченко А.И. Оптимизация условий экспрессии лизил-тРНК-синтетаз в генноинженерных штаммах Escherichia coli // Весцi НАН Беларусi. Сер. бiял. навук. – 2010. – № 1. – С. 65–69.
5. Novagen
pET System Manual, 11th edition /
http://kirschner.med.harvard.edu/files/protocols/Novagen_petsystem.pdf.
6. Бурко
Д.В., Квач С.В., Зинченко А.И. Создание
генно-инженерного штамма-суперпродуцента пирофосфатазы // Умение и
нововъведения–2007: материали за 3-а междунар. науч.-практ. конф., София, 16–31
отомври 2007 г. – Т. 12. – С. 21–25.
7. Wright M., Boonyalai N., Tanner J.A.,
Hindley A.D., Miller A.D.
The duality of LysU, a catalyst for
both Ap4A and Ap3A formation // FEBS J. – 2006. – Vol. 273, № 15. – P. 3534–3544.