Биричевская Л.Л., Зинченко А.И.
Институт микробиологии НАН Беларуси, Минск
выделение
и очистка внеклеточной фосфолипазы D sTREPTOMYCES NETROPSIS
Как известно, фосфолипаза
D (ФЛД) кроме основной гидролитической реакции способна
осуществлять реакцию трансфосфатидилирования, заключающуюся в переносе
фосфатидного остатка на первичную или, в особых условиях, на вторичную
спиртовую группу соединений с образованием их фосфатидильных производных.
Особенное значение имеет синтез коньюгатов фосфолипидов с противовирусными и
противоопухолевыми нуклеозидами [1].
Ранее нами был отобран штамм Streptomyces netropsis БИМ В-235 в качестве
продуцента ФЛД [2]
и изучена субстратная специфичность этого фермента в составе фильтрата
культуральной жидкости (КЖ) в реакции синтеза конъюгатов различных нуклеозидов
с фосфолипидами [3, 4]. Целью данной работы было создание препаратов ФЛД различной
степени очистки.
Материалы и методы.
Культивирование Streptomyces
netropsis БИМ В-235 (далее Str. netropsis), хранящегося в Белорусской коллекции непатогенных
микроорганизмов Института микробиологии НАН Беларуси, и определение активности
ФЛД проводили, как описано нами ранее [3, 5]. Трансферазную активность ФЛД определяли в реакции
переноса фосфатидильного остатка с фосфатидилхолина (лецитина)
на 5′-гидроксильную группу тимидина. Количество образующегося
5′-фосфатидилтимидина определяли с помощью ТСХ на пластинах Silufol-UV254 в системе растворителей
хлороформ–метанол–25%-ный аммиак (14:4:0,15 по объему). За единицу активности фермента принимали такое его количество, которое
обеспечивало трансформацию субстрата или образование продукта в количестве 1
нмоль за 1 мин.
Определение
молекулярной массы нативной ФЛД проводили методом гель-фильтрации на колонке с
гелем Toyopearl HW-55F, уравновешенной 50 мМ Na-ацетатным буфером (рН 6,0), содержащим 0,15 М NaCl.
Результаты
и обсуждение. Высокая активность изучаемой ФЛД в составе фильтрата КЖ, которая
не уменьшается во время его хранения при +4°С не менее полугода, а также тот
факт, что в нем не обнаружено интерферирующих ферментов, способных разрушать
субстраты и продукты реакции трансфосфатидилирования нуклеозидов, позволило
рассматривать непосредственно фильтрат КЖ в качестве одного из препаратов ФЛД
(Фосфолипаза D-1).
Несмотря на возможность непосредственного
применения фильтрата КЖ Str. netropsis
для синтеза фосфатидилнуклеозидов, сухой биокаталитический препарат имеет ряд
преимуществ перед жидкой формой, в особенности при хранении.
Общая схема получения препаратов ФЛД различной степени
очистки представлена на рис. 1.
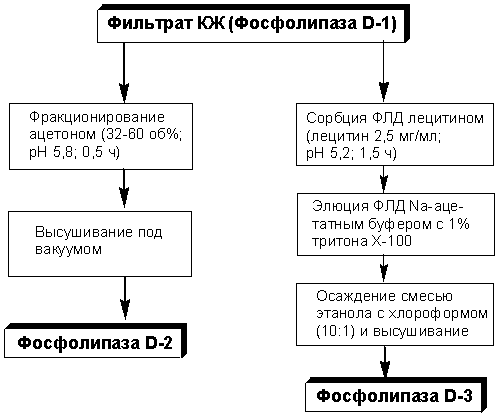
Рис. 1 Схема получения препаратов ФЛД
Для выделения ФЛД из фильтрата КЖ было
реализовано два подхода. С целью получения удобного в применении сухого биокаталитического препарата разработан метод,
включающий фракционирование белков фильтрата КЖ ацетоном (32–60 об.%) при 4°С и
рН 5,8 в течение 0,5 ч, последующее высушивание под вакуумом и механическое
измельчение осадка. Полученный ферментный препарат (Фосфолипаза D-2) высокостабилен (хранится при 4°С без потери активности
не менее 2 лет) и пригоден для синтеза фосфолипидных производных нуклеозидов. Коэффициент
очистки ФЛД составляет 3,2; выход по ферментативной активности – 87%.
Для получения высокоочищенной ФЛД был разработан
простой и эффективный способ, в основе которого лежит его аффинная сорбция
лецитином. При этом непосредственно в фильтрате КЖ суспендируется лецитин,
после связывания фермента с субстратом осуществляется его осаждение
центрифугированием, элюция с помощью натрий-ацетатного буфера (рН 5,6) с 1% тритона
Х-100, диализ, осаждение этанолом и вакуум-сушка. После оптимизации таких
параметров, как величина рН (5,2), концентрация лецитина (2,5 мг/мл) и время инкубации
(1,5 ч), удается сорбировать на лецитин до 90% фермента. В целом, метод
позволяет добиться очистки ФЛД в 105 раз с выходом 72%. Полученный препарат
высокоочищенной ФЛД (Фосфолипаза D-3) использовали
для исследования основных физико-химических свойств фермента.
Методами гель-фильтрации и гель-электрофореза
в полиакриламидном геле в присутствии додецилсульфата натрия
установлено, что ФЛД Str. netropsis представляет собой несубъединичный белок с
молекулярной массой 36–37 кДа. При изучении рН- и термостабильности ФЛД
выявлено, что фермент нестабилен при инкубации в кислых растворах и проявляет
устойчивость в интервале рН 5,5–8,0 и при температурах, не превышающих 55оС.
Максимальную трансферазную активность в реакции синтеза фосфатидилнуклеозидов фермент
проявляет при рН 6,0 и температуре 45оС (рис. 2).
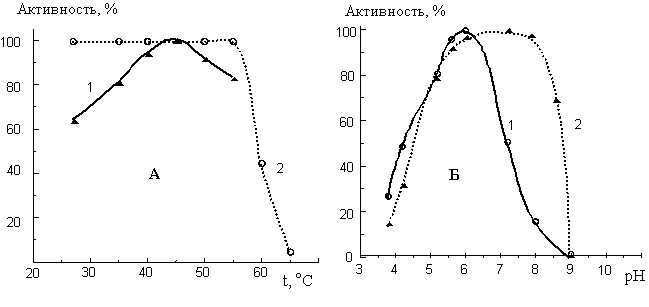
Рис.
2. Влияние температуры (А) и рН (Б) на активность (1)
и
стабильность (2) ФЛД Str. netropsis
Литература:
1. Alexander, R.L. Lipid nucleoside conjugates for the treatment of
cancer / R.L. Alexander, G.L. Kucera // Carr. Pharm. Design. – 2005. – Vol. 11,
№ 9. – P. 1079–1089.
2. Фещенко,
Л.Л. Первичный отбор продуцентов микробной фосфолипазы D / Л.Л. Фещенко [и др.]
// Микробиология и биотехнология на рубеже XXI столетия: материалы междунар.
конф., Минск, 1–2 июня 2000 г. – C. 135–136.
3. Субстратные
требования фосфолипазы D из Streptomyces netropsis при синтезе фосфолипидов по реакции трансфосфатидилирования
/ Л.Л. Биричевская [и др.] // Химия природ. соединений. – 2006. – № 1. – С. 26–29.
4. A comparison of enzymatic
phosphorylation and phosphatidylation of β-L- and β-D-nucleosides / L.L. Birichevskaya [et al.] // Biotechnol.
Lett. – 2007. – Vol. 29, № 2/3. – P. 585–591.
5. Биричевская, Л.Л. Влияние
состава питательной среды и условий культивирования на продуцирование
фосфолипазы D
культурой Streptomyces netropsis БИМ В-235 / Л.Л. Биричевская, А.И.
Зинченко // Научное пространство Европы-2007: материалы III международ. научно-практ. конф., Днепропетровск, 16–30
апреля 2007 г. – Т. 5. – С. 6–15. 