Катализаторы оксигенирования углеводородов на основе
металлокомплексов с природными полимерами
Ж.Х.Ташмухамбетова,
Л.А.Шокорова, Каирбеков Ж.К., А.Б.Хасенова
Казахский национальный университет им. аль-Фараби НИИ
НХТ и М,
050012, Республика Казахстан,
г. Алматы,
ул.Карасай батыра 95а, e-mail: zheneta@mail.ru
Одним из
наиболее важных процессов современной нефтехимии является реакция
оксигенирования углеводородов с целью получения важнейших продуктов и сырья для
органического синтеза. Особое место занимает жидкофазное оксигенирование
углеводородов в присутствии комплексов на основе металлов с переменной
валентностью, иммобилизованных на полимерную матрицу. Поиск оптимальной матрицы
для нанесения активного металла привел нас к природным органическим полимерам,
таким как гумусовые органические вещества или гуминовые кислоты (ГК).
В настоящем сообщении
представлены экспериментальные
результаты оксигенирования толуола в системе ![]() (ПИП- полиимидная пленка) при температурах 338-358 K и атмосферном давлении. Реакцию осуществляли
по известной методике [1]. Было показано, что в ходе процесса потенциал системы
смещается в катодную область, а скорость в зависимости от количества
поглощенного кислорода имеет аутокаталитический характер. Степень превращения толуола в
течение 60 минут достигает от 5 до 17 % в зависимости от состава каталитической
системы. Селективность по бензальдегиду составляет 86%.
(ПИП- полиимидная пленка) при температурах 338-358 K и атмосферном давлении. Реакцию осуществляли
по известной методике [1]. Было показано, что в ходе процесса потенциал системы
смещается в катодную область, а скорость в зависимости от количества
поглощенного кислорода имеет аутокаталитический характер. Степень превращения толуола в
течение 60 минут достигает от 5 до 17 % в зависимости от состава каталитической
системы. Селективность по бензальдегиду составляет 86%.
В ИК- спектре образца катализата
присутствуют четкие полосы поглощения карбонильной группы (С=О в области
валентных колебаний при 1800-1650 см-1), ароматического кольца (в
области деформационных колебаний при
800-690 см-1), что свидетельствует о преимущественном образовании
бензальдегида.
Согласно анализам катализата (ИКС и ГХА) процесс оксигенирования толуола
протекает в соответствии с реакцией (1).
C6H5CH3 + O2 ® C6H5СНО + H2O (1)
Редокс - потенциал системы C6H5CH3 – О2 - СоCl2 – ГК - ПИП – Н2О при изменении
концентрации Сo(II) находится в интервале значений от 0,6 до 0,76 В. На
основании данных диаграммы Пурбэ для растворов солей переходных металлов (при
рН=7-9) было сделано
предположение о том, что редокс-потенциал исследуемой каталитической системы
описывается уравнением Нэрнста (2):
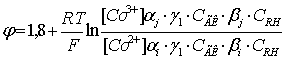 (2)
(2)
С ростом ![]() количество
поглощенного кислорода увеличивается, степень превращения толуола колеблется в
интервале от 5,0 до 18,7%. Оптимальной является концентрация 1,0·10-2
моль/л.
количество
поглощенного кислорода увеличивается, степень превращения толуола колеблется в
интервале от 5,0 до 18,7%. Оптимальной является концентрация 1,0·10-2
моль/л.
Образвание комплексов кобальта с ГК подтверждено
спектральными методами ИК и УФ.
Установлено,
что увеличение концентрации гуминовой
кислоты (от 0 до 1,0×10-2 моль/л) приводит к повышению скорости
поглощения кислорода от 1,5×10-5 до ![]() , не влияет на стехиометрию реакции окисления толуола,
увеличивая потенциал системы. Зависимость скорости поглощения кислорода от
исходной концентрации гуминовой кислоты, описывается уравнением (3):
, не влияет на стехиометрию реакции окисления толуола,
увеличивая потенциал системы. Зависимость скорости поглощения кислорода от
исходной концентрации гуминовой кислоты, описывается уравнением (3):
![]() , (3)
, (3)
где α - константа комплексообразования, которая
относится к равновесию (4): ![]() (4)
(4)
Согласно
уравнению (3) при 348 K k = 1,4 л/(моль·c), ![]() .
.
Было исследовано
влияние температуры на процесс окисления толуола при оптимальных концентрациях
компонентов реакции. Согласно экспериментальным результатам, в изученном
температурном интервале 338¸358 K зависимость скорости реакции
(1) хорошо описывается уравнением Аррениуса:
![]() .
.
Таким образом,
катализаторы на основе комплексов кобальта и гуминовой кислоты, нанесенные на
полиимидную пленку, позволяют осуществить процесс оксигенирования толуола в
мягких технологических режимах (в водном растворе, при температуре 348 K,
атмосферном давлении) с высокой степенью превращения толуола. Окисление толуола осуществляется через образование и
редокс превращение промежуточного комплекса [CoCl(ГК)О2(С6Н5СН3)].
Список
литературы:
1. Кожалакова
Н.А., Бескемпирова Ж.Б., Рахманбергенова Н.С., Ташмухамбетова Ж.Х., Шокорова
Л.А. Катализ комплексами металлов переменной валентности, иммобилизованных на
полимерную матрицу, процесса оксигенирования углеводородов.//
Сб.материалов X Юбилейной Всероссийской
конференции студентов и аспирантов «Химия и химическая технология в 21 веке», Томск:ТПУ.2009.
С.108-109