Химия и химические технологии/6. Органическая химия
Федотова Е.И., д.х.н., профессор Белик А.В.
Челябинский государственный университет, Россия
Квантово-химическое рассмотрение
молекулы тринитрометана
Данная
работа посвящена исследованию электронного строения и силовых
коэффициентов молекулы тринитрометана. Ранее нами уже было найдено силовое поле
молекулы нитрометана [1]. Тринитрометан наиболее изучен из тринитроалканов. На
сегодняшний день существует достаточно большое количество работ, посвященных
способам синтеза различных производных тринитрометана, а также
спектроскопическим исследованиям его галогенпроизводных [2-5]. Мы поставили
перед собой цель решить колебательную задачу для тринитрометана более
корректно, чем в естественных координатах, используя координаты Хδ0.
С использованием базиса 6-31G(d,p) гибридного метода функционала плотности B3LYP, определены
геометрические параметры молекулы. Полученные данные приведены в таблице 1 и на
рисунке 1. Можно отметить их хорошее согласие с экспериментальными и
литературными данными.
Таблица 1.
Геометрические параметры молекулы тринитрометана
|
Параметр |
Эксп. (газ) [6,7] |
B3LYP 6-311+G(d,p) [7] |
B3LYP 6-31(d,p) |
|
Длина связи (Å) |
|||
|
C-H C-N N-OI NOII |
1.130 1.505 1.219 1.219 |
1.085 1.526 1.209 1.214 |
1.086 1.517
1.220
1.217 |
|
Угол (град) |
|||
|
NCH CNOI CNOII ONO NCN |
108.2 115.7 115.7 128.6 110.7 |
109.2 118.0 113.4 128.6 109.8 |
109.5 117.6 113.6 128.7 109.5 |
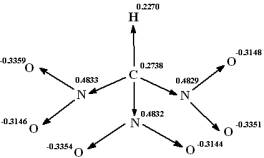
Рис.1. Вектора связей и заряды на атомах в молекуле тринитрометана.
Получено, что расстояния между ближайшими
атомами кислорода соседних нитрогрупп превышают сумму Ван-дер-ваальсовых
радиусов атома кислорода. Следовательно, стерические взаимодействия нитрогрупп
при одном атоме углерода незначительны [8].
Используя
расчетную равновесную геометрию молекулы, была вычислена матрица силовых
коэффициентов тринитрометана, которая затем была переведена из декартовой
системы координат в координаты Хδ0,
в которых каждый вектор связи рассматривается в своей «собственной» декартовой
системе координат каждого вектора связи, обозначенного на рисунке 1 [9]. Как и
в работе [1], для практических целей характеристики жесткости связей в
молекуле, были использовали величины, представляющие след субматрицы (3х3)
каждого из векторов связей (в
координатах Хδ0 ). Эти величины указаны на рисунке 2 вдоль линий соответствующих
валентных связей, совпадающих с векторами связей. Они были названы
«объединенными значениями» силовых коэффициентов связей, представляющими сумму
соответствующих величин по осям x,y,z.
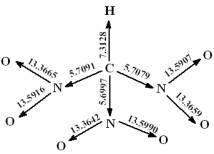
Рис.2. «Объединенные значения» силовых
коэффициентов (mdyn/Å)
для выбранных векторов связей в координатах Хδ0
В таблице 2 приведены собственные частоты колебаний
молекулы тринитрометана.
Таблица 2.
Собственные частоты колебаний молекулы СН(NO2)3 (см-1).
|
Эксп. (газ) ИК [8] |
B3LYP 6-31(d,p) |
Отнесение |
|
1600 1369 1302 1251 943 835 774 625 570 |
1718 1436 1370 1263 944 847 786 629 572 |
υa(NO2) υs(NO2) υs(NO2) r┴(CH3) υ(CN) υ(CN) - δ(ONO) - |
В спектре обращает на себя внимание
наличие симметричных колебаний CN-связи 835 и
943 см-1. Эффекты, которые наблюдаются в спектрах производных
тринитрометана, обычно связывают с изменением электронных параметров самих
нитрогрупп [8]. В результате, впервые получено силовое поле молекулы
тринитрометана в координатах Хδ0, имеющих простую
химическую интерпретацию.
Литература:
1. Белик А.В., Федотова Е.И. Квантово-химическое исследование силового поля нитрометана в координатах Хδ0. Бутлеровские сообщения. 2011. Т.25. №5. С.60-63.
2. Волкова Ю.А., Иванова О.А., Аверина Е.Б., Будынина Е.М., Кузнецова Т.С., Зефиров И.С. Изучение реакции тринитрометана с оксиранами. Доклады АН. 2008. Т.419. №4. С.500-503.
3. Левин А.А, Дахис М.И., Шляпочников В.А., Новиков С.С. Электронное строение, конформации, колебательные спектры тринитрометана и его галоидзамещенных. Материалы III Всесоюзной конференции по исследованию строения органических соединений физическими методами. Казань. 1971. С.133-134.
4. Шляпочников В.А., Файнзильберг А.А., Новиков С.С. Спектры и строение галоидпроизводных тринитрометана. Изв. АН СССР. Серия химическая. 1962. №3. С.519-520
5. Шляпочников В.А., Оленева Г.И., Новиков С.С. Анализ колебательных спектров щелочных солей тринитрометана. Изв. АН СССР. Серия химическая. 1971. №11. С.2603-2606.
6. Садова Н.И., Вилков Л.В. Геометрия молекул нитросоединений. Успехи химии. 1982. Т.51. №1. С.153-184
7. Левченков Д.В., Харитонкин А.Б., Шляпочников В.А. Структура производных тринитрометана. Изв. АН. Серия химическая. 2001. №3. С.368-372.
8. Новиков С.С., Швехгеймер Г.А., Севостьянова В.В., Шляпочников В.А. Химия алифатических и алициклических нитросоединений. М.: Химия. 1974. 416с.
9. Mayants L.S., Shaltuper G.B. General methods of analyzing molecular vibrations. Journal of Molecular Structure. 1975. Vol.24. P. 409-431.