Кухарская Т.А., к.б.н. Ерошевская Л.А.,
к.х.н. Кулак Т.И.*,
д.х.н.
Калиниченко Е.Н.*, д.б.н. Зинченко А.И.
Институт
микробиологии НАН Беларуси, Минск
*Институт
биоорганической химии НАН Беларуси, Минск
Получение
Иммобилизованного комплекса
(3'-5')-специфическая
нуклеаза/фосфатаза
(2'-5')-Олигоаденилаты
представляют собой олигонуклеотиды, состоящие из нескольких фрагментов
аденозина, связанных между собой не канонической (3'-5')-, а изомеризованной
(2'-5')-фосфодиэфирной связью. Эти соединения обладают разнообразной
биологической активностью, среди которых наибольшее внимание привлекает
активностью против вирусов растений и животных [1–4].
Главными недостатками
химических способов получения (2'-5')-олигоаденилатов является их
нетехнологичность [5]. На наш взгляд, более перспективным является
химико-ферментативный метод получения, предложенный Карпейским [6]. Метод
предусматривает химическую полимеризацию аденозин-2'(3')-монофосфата,
приводящую к полиадениловой кислоте, содержащей как (3'-5')-, так и (2'-5')-межнуклеотидные
связи (далее (3'-5')/(2'-5')-поли-А. Обработка такого полимера рибонуклеазой Penicillium brevicompactum, гидролизующей только
(3'-5')-межнуклеотидные связи, и щелочной фосфатазой Еscherichia coli, дефосфорилирующей олигонуклеотиды,
приводит к образованию смеси (2'-5')-олигоаденилатов.
Ранее мы селектировали штаммы
гриба Spicaria violacea (синоним Paecilomyces marquandii), фильтрат культуральной жидкости (ФКЖ)
которого содержат фосфатазу и особую нуклеазу, способную гидролизовать
(3'-5')-, но не (2'-5')-фосфодиэфирные связи [7]. С использование ферментов
этого гриба был разработан способ химико-ферментативного получения
(2'-5')-олигоаденилатов, заключающийся в избирательном гидролизе химически
синтезированного полиаденилата, содержащего (3'-5')- и (2'-5')-межнуклеотидные
фосфодиэфирные связи [8]. Цель настоящей работы заключалась в получения
активного и стабильного катализатора, который можно было бы многократно
использовать в синтезе (2'-5')-олигоаденилатов.
Объекты и методы исследования. В работе использовали штамм гриба Paecilomyces marquandii БИМ F-351Д (Белорусская коллекция непатогенных
микроорганизмов). Условия культивирования гриба и получение ФКЖ описаны нами в
работе [9]. (2'-5')/(3'-5')-поли-А получали полимеризацией аденозин-2'(3')-монофосфата
в диоксане [6].
Активность изучаемого
комплекса ферментов определяли по скорости накопления аденозина при гидролизе
(2'-5')/(3'-5')-поли-А. Для этого смесь (0,5 мл), содержащую 5 мг/мл
(2'-5')/(3'-5')-поли-А в 0,1 М Na-ацетатном буфере (рН 6,0), 10 мМ MgCl2 и 250 мкл ФКЖ Р. marquandii, инкубировали 2 ч при 50оС. В
процессе реакции аликвоты смеси подвергали тонкослойной хроматографии на
пластинках Silufol-UV254 (Serva, Германия) в системе растворителей
изопропанол – 25%-ный аммиак – вода (7:1:2). За единицу активности ферментативного комплекса принимали такое его
количество, которое обеспечивало образование 1 нмоль продукта за 1 ч реакции.
Иммобилизацию ферментов на
Биогеле Р-300 «Bio-Rad» (США) осуществляли, согласно методу,
описанному в работе [10]. Для
иммобилизации ферментов на фосфоцеллюлозу (ФЦ) к 50 мг смолы в Н+-форме
добавляли 0,5 мл ФКЖ гриба и смесь инкубировали 30 мин при комнатной
температуре с периодическим встряхиванием. ФЦ от жидкости отделяли фильтрованием.
Результаты и обсуждение. Преимущества гетерогенных катализаторов перед растворимыми
ферментами общеизвестно и неоднократно рассматривались в литературе [11]. При
этом немаловажной задачей при решении проблемы получения иммобилизованных
ферментов является выбор подходящего носителя. Из требований, обычно
предъявляемых к носителю, следует
отметить следующее: он не должен инактивировать фермент, он должен обладать
гидрофильностью и механической устойчивостью. В настоящее время имеется широкий
выбор носителей для ферментов – органических и неорганических. Для каждого
конкретного случая выбор носителя производится эмпирически.
На начальном этапе работы нами была предпринята
попытка использовать химический метод иммобилизации с применением
активированного глутаровым альдегидом (ГА) Биогеля Р-300. Выбор ГА для указанного исследования был обусловлен тем,
что, во первых, этот бифункциональный реагент способен стабилизировать
различные ферменты [12, 13]. Во вторых, ГА быстро реагирует с белками в мягких
условиях проведения реакции и, вероятно, является среди таких соединений
наименее токсичным [10].
Результаты экспериментов по иммобилизации
ферментативного комплекса на Биогель представлены в табл. 1. Видно, что только
20% от исходной ферментативной активности, присутствующей в ФКЖ, связывается с
активированной матрицей. 30% активности вообще теряется во время иммобилизации.
Таблица 1 − Иммобилизация
ферментного комплекса на Биогель
|
Длительность процесса иммобилизации, ч |
Комплекс, связавшийся матрицей, % от
исходной активности |
Комплекс, не связавшийся с матрицей, %
от исходной активности |
|
1 |
20 |
50 |
|
3 |
21 |
50 |
|
6 |
23 |
45 |
|
18 |
23 |
40 |
Проведение реакции при 4оС не
привело к увеличению эффективности иммобилизации, а введение дополнительной
стадии промывки геля привело к потере активности, что говорит о слабой сорбции
ферментов с помощью данного метода. Это может быть
связано с малым количеством реакционноспособных остатков в ферменте, способных
связываться с сорбентом с помощью ГА.
Одним из удобных методов иммобилизации
ферментов является их фиксация на ионообменных матрицах, в частности на ФЦ.
Метод основан на том, что фермент содержит ряд функциональных положительно
заряженных групп, которые могут принимать участие в образовании ионной связи с
отрицательно заряженными остатками фосфорной кислоты, закрепленными на
целлюлозе.
Рисунок иллюстрирует
результаты эксперимента, в котором изучалось влияние рН среды при иммобилизации
ферментов на операционную стабильность иммобилизованного ферментного комплекса.
С этой целью к аликвоте ФЦ с иммобилизованными ферментами добавляли субстрат и
вели гидролиз в течение 15 мин. Затем реакционную смесь центрифугировали и к
сорбенту повторно добавляли свежий субстрат. Видно, что ферменты хорошо
связываются с матрицей в широком интервале рН, но наибольшую операционную стабильность
проявляют образцы, полученные с использованием рН в пределах 5–7.
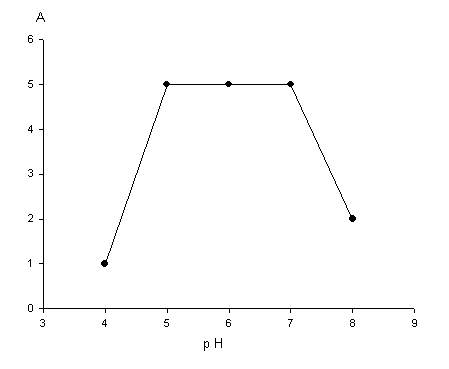
Рисунок – Влияние рН на иммобилизацию
ферментного комплекса.
А – число катализируемых циклов с выходом целевого продукта
>95%
В ходе следующего
эксперимента, для выяснения наиболее оптимального температурного режима реакции
гидролиза (2'-5')/(3'-5')-поли-А, её проводили при трех разных температурах.
Данные этих экспериментов представлены в табл. 2.
Таблица 2 − Влияние температуры на операционную
стабильность иммобилизованного ферментного комплекса
|
Температура гидролиза, оС |
Выход реакции, % |
|||||||||
|
Циклы |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
40 |
>95 |
>95 |
75 |
66 |
61 |
59 |
51 |
50 |
40 |
37 |
|
50 |
>95 |
>95 |
>95 |
>950 |
>95 |
72 |
62 |
50 |
47 |
40 |
|
60 |
>95 |
>95 |
71 |
50 |
48 |
45 |
40 |
31 |
27 |
20 |
Как видно их данных, представленных в
табл. 2, наиболее благоприятной для иммобилизованного ферментного комплекса
оказалась температура 50оС, при которой он способен провести 5
циклов гидролиза субстрата без снижения эффективности этого процесса.
Таким образом, в
результате выполненных исследований получен препарат иммобилизованного ферментного комплекса, состоящего из (3'-5')-специфической
нуклеазы и фосфатазы, который способен проводить 5 циклов гидролиза (3'-5')/(2'-5')-поли-А до смеси
(2'-5')-олигоаденилатов без потери эффективности.
Литература:
1.
Devash, Y. Maltiplication of tobacco mosaic virus in
tobacco leaf disks is inhibited by (2′-5′)oligoadenylate / Y.
Devash, S. Biggs, I. Sela // Science. – 1982. – Vol. 216, № 4553. – P.
1415–1416.
2.
Kara, J. Изучение антивирусного и антиклеточного действия синтетического
(2′-5′)-олигоаденилата
(A2′p5′A2′p5′A) на мышах с лейкемией Раушера / J.
Kara, O. Mach, J. Smrt // Acta Virol. – 1983. – Vol. 27, № 6. – P. 477–483.
3.
5'-dephosphorylated 2',5'-adenylate trimer and its
analogs. Inhibition of tobacco mosaic virus replication in tobacco mosaic
virus-infected leaf discs, protoplasts, and intact tobacco plants / Y. Devash
[et al.] // J. Biol. Chem. – 1984. Vol. 259, № 6. – P. 3482–3486.
4.
Кaнавалава, Г.I. Выкарыстанне iнгiбiтарау вiрусау пры аздарауленнi бульбы метадам культуры тканкi / Г.I. Кaнавалава // Весцi АН Беларусi. Сер. бiял. навук. – 1990, № 6. – С. 70–72.
5.
Nucleotides. XXIV. Preparative synthesis of trimeric
(2'-5')oligoadenylic acid / E.I. Kvasyuk [et al.] // Synthesis. – 1987. – № 6.
– P. 535–541.
6.
Применение нуклеаз для синтеза
2′-5′-олигоаденилатов и их аналогов / М.Я. Карпейский [и др.] // Биоорган. химия. – 1983. – Т. 9, № 4. – С. 496–504.
7.
Присутствие
нуклеазы, специфичной к (3'–5')-межнуклеотидным фосфодиэфирным связям, в
культуральной жидкости мицелиального гриба Spicaria
violacea / Т.А. Кухарская [и др.] // Современное состояние и перспективы развития
микробиологии и биотехнологии: материалы Междунар. конф., Минск-Раков, 1–2 июня
2006 г. – Минск, 2006. – С. 171–173.
8.
Химико-энзиматический
синтез 2′,5′-олигоаденилатов с использованием нуклеазы
мицелиального гриба Spicaria violacea / Т.И. Кулак [и др.] // Химия природных
соединений. – 2007. – № 2. – С. 200–201.
9.
Факторы,
влияющие на образование комплекса (3'−5')-специфическая
нуклеаза/фосфатаза грибом Spicaria violacea / Т.А. Кухарская [и др.] // Умение и
нововъведения – 2007: материали за 3-а Междунар. научна практична конференция,
София, 16–31 отомври 2007 г. – Т. 12. – С. 9–13.
10. Тривен, М. Иммобилизованные ферменты / под
ред. И.В. Березина. – М.: Мир,
1983. – 213 с.
11. Santos,
A.M. Modeling thermal stability and activity of free and immobilized enzymes as
a novel tool for enzyme reactor design / A.M. Santos, M.G. Oliveira, F. Maugeri
// Bioresour. Technol. – 2007. – Vol. 98, № 16. – Р. 3142–3148.
12. Khan,
S.S. Studies on chemically aggregated pepsin using glutaraldehyde / S.S. Khan,
A.M. Siddiqi // Biotechnol. Bioeng. – 1985. – Vol. 27, № 4. – P. 415–419.
13.
Зинченко,
А.И. Увеличение операционной стабильности клеток Escherichia coli, катализирующих реакцию синтеза аденинарабинозида, с помощью
глутарового альдегида / А.И. Зинченко, Л.А. Ерошевская, В.Н. Барай //
Биотехнология. – 1990. – № 5. – С. 36–39.