К.б.н. Титович О.И., к.б.н. Квач С.В., д.б.н. Зинченко
А.И.
Институт
микробиологии НАН Беларуси, Минск
создание
генно-инженерного
штамма-продуцента
азурина
В последнее время внимание ряда исследователей
привлечено к хорошо известному белку бактерии Pseudomonas aeruginosa – азурину – в качестве потенциального
противоопухолевого агента. Азурин принадлежит к медьсодержащим белкам,
называемым также голубыми белками, из-за их интенсивной голубой окраски (λmax
= 630 нм; ε ≈ 5000 М-1·см-1; редокс-потенциал
320 мВ). Этот протеин участвует в реакциях переноса электронов в некоторых
растениях и бактериях [1].
Согласно недавним исследованиям, механизм
противоопухолевого действия азурина связан с его способностью проникать в
опухолевые клетки и стабилизировать белок р53, известный как опухолевый
суппрессор, запускающий сложный механизм остановки неконтролируемого деления
раковой клетки, либо активирующий механизм апоптоза. Азурин предотвращает деградацию
р53, повышая таким образом его внутриклеточный уровень, что приводит к гибели
опухолевой клетки [2].
Азурин эффективен против нескольких типов опухолевых
клеток (рак груди, кожи), против малярийного паразита Plasmodium falciparum и ВИЧ-1 [3], что делает его потенциальным
лекарственным препаратом широкого спектра действия.
Целью настоящего исследования было создание
бактериального генно-инженерного штамма-продуцента белка азурина Ps. aeruginosa.
Материалы и
методы исследования. В работе
использовали: бактерии Ps. aeruginosa
БИМ В-153 (Белорусская коллекция непатогенных микроорганизмов) в качестве
донора гена, кодирующего азурин; штамм Escherihia coli BL21(DE3) – в качестве акцептора рекомбинантного вектора, несущего ген
азурина, и штамм E. coli DH5α,
служащий промежуточным хозяином для наработки и анализа рекомбинантного
вектора.
Культивирование всех штаммов проводилось при 37oС на среде LB (рН 7,2), содержащей (г/л): триптон
– 10,0; NaCl – 10,0; дрожжевой экстракт – 5,0. Штаммы, содержащие
плазмиды и векторы на их основе, культивировались на среде с канамицином в
концентрации 50 мкг/мл.
Ген azu, кодирующий азурин, был выделен с помощью
полимеразной цепной реакции (ПЦР) с использованием в качестве матрицы геномной
ДНК Ps. aeruginosa.
Подбор праймеров для ПЦР проводили, используя данные о первичной структуре гена
azu.
Для амплификации участков ДНК, кодирующих предшественник азурина и
непосредственно азурин использовали две пары праймеров (azuF1/azuR и azuF2/azuR,
соответственно), представленных в табл. 1. На 5′-концах праймеров были
встроены сайты рестрикции эндонуклеаз NdeI
и HindIII (выделено жирным).
Таблица 1 – Праймеры, использованные при
конструировании рекомбинантных векторов
|
Название |
Нуклеотидная
последовательность (5’→3’) |
|
azuF1 |
AActtgcatatgctacgtaaactcgctgcggtatc |
|
azuF2 |
aacttgcatatggccactgctggctgccgagt |
|
azuR |
ataagcttcacttcagggtcagggtgcccttc |
Продукты амплификации разделяли путем электрофореза в
1,5%-ном агарозном геле, обрабатывали рестрикционными эндонуклеазами NdeI и HindIII и лигировали в вектор pET24b+, рестрицированный по
тем же сайтам и обработанный щелочной фосфатазой.
Клетки E. coli BL21(DE3),
несущие плазмиду с геном азурина, выращивали на LB-среде до оптической
плотности 0,6 (λ = 600 нм), затем проводили индукцию синтеза белка путем
внесения изопропил-β-D-тиогалактопиранозида
(ИПТГ) до концентрации 1 мМ и продолжали культивирование в течение 3–5 ч.
По окончании культивирования клетки осаждали
центрифугированием при 7 000 g (10 мин) и
дважды промывали 50 мМ Трис-HCl буфером (рН
8,0). Для получения цитоплазматической фракции белков 10%-ную суспензию бактериальных
клеток обрабатывали ультразвуком на ультразвуковом дезинтеграторе
микроорганизмов UDM-10 (Techpan, Польша) при мощности 0,5 кВт в течение 3–5 мин.
Обломки клеток осаждали центрифугированием при 20 000 g (20 мин).
Периплазматическую фракцию белков получали следующим
образом. Осадок бактериальных клеток ресуспендировали в растворе, содержащем
25%-ную сахарозу, 0,3 М Трис-HCl (рН 8,1) и 1
мМ ЭДТА. Суспензию инкубировали при комнатной температуре 10–15 мин, затем
клетки осаждали центрифугированием при 7 000 g (10 мин). Супернатант отбрасывали, а клетки ресуспендировали
в охлажденном 0,5 мМ MgCl2, инкубировали на льду 20 мин и центрифугировали при
20 000 g (20 мин). Супернатант использовали в качестве периплазматической
фракции белков.
Анализ белкового состава полученных фракций проводили
с помощью электрофореза в полиакриламидном геле, содержащем додецилсульфат натрия
(ДСН), используя 12,5%-ный разделяющий и 4%-ный концентрирующий гели [4]. По
окончании электрофореза белки окрашивали красителем Кумасси R-250.
Результаты
и обсуждение. Азурин является
периплазматическим белком бактерии Ps. aeruginosa.
Ген azu кодирует полипептидный предшественник, состоящий из
сигнальной последовательности (необходимой для транслокации белка в
периплазматическое пространство) длиной 19 аминокислот и непосредственно
азурина, состоящего из 128 аминокислот [1].
Ген azu и
участок данного гена, кодирующий азурин без сигнальной последовательности, были
изолированы из геномной ДНК Ps. aeruginosa
БИМ В-153 с помощью ПЦР и встроены в плазмиду рЕТ24b+ под контролем Т7-промотора. Таким образом, были
сконструированы два вектора – рЕТazu1, несущий
полноразмерный ген азурина, и рЕТazu2, несущий
участок гена, кодирующий азурин. Полученными плазмидами трансформировали клетки
E. coli BL21(DE3). В
результате были получены штаммы E. coli:azu1 и E. coli:azu2, несущие рекомбинантные плазмиды рЕТazu1 и рЕТazu2, соответственно.
Для индукции синтеза целевого белка к
растущим культурам E. сoli:azu1 и E. coli:azu2 добавляли индуктор (ИПТГ) в концентрации 1 мМ и
продолжали культивирование в течение 3–5 ч. Контроль синтеза белка осуществляли
с помощью ДСН-полиакриламидного гель-электрофореза (рис. 1).
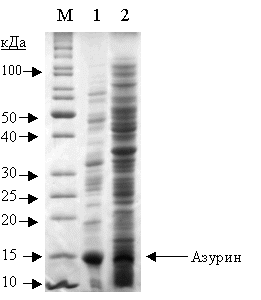
Рис. 1. Электрофореграмма белкового состава
периплазматической (1) и цитоплазматической (2) фракций бактерий E. coli:azu1 и E.
coli:azu2, соответственно.
М – положение маркерных белков.
Из полученных результатов видно, что в
периплазматической фракции бактерий E.
coli:azu1 накапливается белковый
продукт с молекулярной массой около 14 кДа, что соответствует молекулярной
массе азурина Ps. aeruginosa
[1].
По литературным данным, экспрессия гена
азурина в бактериях E. coli
происходит таким образом, что сначала белок синтезируется в виде предшественника,
который затем расщепляется в процессе экспорта в периплазматическое
пространство. При этом рекомбинантный азурин имеет аминокислотную
последовательность и спектральные характеристики идентичные азурину Ps. aeruginosa [5].
Второй из полученных нами генно-инженерных
штаммов (E. coli:azu2), содержит плазмиду без сигнальной
последовательности азурина, поэтому целевой белок накапливается непосредственно
в цитоплазме бактерий. Следует отметить, что количество его незначительно по
сравнению с общим белком, содержащимся в клетке. Очевидно, что данное
обстоятельство может значительно осложнить выделение и очистку азурина.
Таким образом, для дальнейшей работы по
разработке метода выделения и очистки азурина был выбран штамм E. coli:azu1, в периплазматической фракции которого накапливается
целевой белок в количестве не менее 40% от общего водорастворимого белка
клетки.
Литература:
1. Arvidsson R.H., Nordling
M., Lundberg
L.G. The azurin gene from Pseudomonas aeruginosa. Cloning and
characterization // Eur. J. Biochem. – 1989. – Vol. 179, №1. – P. 195–200.
2. Fialho A.M., Stevens F.J., Das Gupta T.K., Chakrabarty A.M. Beyond
host-pathogen interactions: microbial defense strategy in the host environment
// Curr. Opin. Biotechnol. – 2007. – Vol. 18, № 3. – P. 279–286.
3. Chaudhari A., Failho A.M., Ratner D., Gupta., Hong C.S., Kahali S.,
Yamada T., Haldar K., Murphy S., Cho W., Chauhan V.S., Das Gupta T.K.,
Chakrabarty A.M. Azurin, Plasmodium falciparum
malaria and HIV/AIDS. Inhibition of parasitic and viral growth by Azurin //
Cell Cycle. – 2006. – Vol. 5, № 15. – P. 1642–1648.
4.
Laemmli U.K. Cleavage of structural proteins during the assembly of the head of
bacteriophage T4 // Nature. – 1970. – Vol. 227, № 259. – P. 680–685.
5. Karlsson B.G.,
Pascher T., Nordling M., Arvidsson R.H., Lundberg L.G. Expression of the blue
copper protein azurin from Pseudomonas
aeruginosa in Escherichia coli //
FEBS Lett. – 1989. –Vol. 246, № 1–2. – P. 211–217.