Гладилина Ю.А., Соколов Н.Н., Красоткина Ю.В.
Государственное учреждение Научно-исследовательский институт
биомедицинской химии им. В.Н. Ореховича, г.Москва, Россия
Оптимизация экспрессии рекомбинантной L-аспарагиназы Helicobacter pylori
Бактериальные аспарагиназы – единственный пример
практического использования ферментов в онкотерапии. Их препараты применяют в
комбинированной химиотерапии при лечении острых лимфобластных лейкозов (ОЛЛ) у
детей [1, 2]. В последнее время появились сообщения о попытках использования
аспарагиназ для лечения острой миелобластной лейкемии [3], болезни Ходжкина и
не-Ходжкинской лимфомы [4], меланосаркомы и множественной миеломы [5].
Однако применение аспарагиназы в клинической практике
осложняется рядом побочных эффектов такими, как поражения печени и
поджелудочной железы, нейротоксичность, тромбозы и эмболии, иммуносупрессивное
действие [2]. Глутаминазная активность фермента - одна из основных причин
токсичности аспарагиназы. [6]. Глутамин является основной формой транспорта азота
в крови и длительное истощение его содержания в процессе химиотерапии с
применением аспарагиназы приводит к нарушению различных биохимических процессов
в организме. Известно, что, например, аспарагиназа Erwinia carotovora
содержит до 10 % L-глутаминазной активности [7], а
у аспарагиназ из Vibrio succinogenes, Mycobacterium bovis, Helicobacter pylori глутаминазная активность полностью
отсутствует.
В настоящее время широкое использование в медицине
находят генно-инженерные лекарственные препараты белковой природы, поскольку
они имеют очевидные преимущества перед нативными белками. Один и тот же
микроорганизм может использоваться как продуцент различных ферментных
препаратов, что унифицирует технологию их получения. При этом выход ферментов
значительно увеличивается. [8]. Поэтому цель данной работы состояла в оптимизации
экспрессии рекомбинантной L-аспарагиназы
H. pylori в клетках E.coli и получении
микробной массы с высокой ферментативной активностью.
Материалы и методы. В работе использовали штаммы E. coli BL21(DE3)
(F-, ompT, hsdSB, (rB-, mB-),
dcm, gal, λ(DE3)) и E. coli BL21(DE3)pLysS (F-, ompT, hsdSB, (rB-rB-), dcm, gal, (DE3), pLysS, Cmr), несущие рекомбинантную
плазмиду pET22b/HpA, сконструированную нами и направляющую синтез L-аспарагиназы Helicobacter pylori.
Штамм-продуцент выращивали на
питательной среде LB рН 7,2 ± 0,1, с содержанием антибиотика ампициллина в конечной
концентрации - 100 мкг/мл. Выращивание проводили на термостатированной качалке
«GFL 3033» (Германия) при температуре
25, 30 или 370С в зависимости от целей эксперимента. Объем среды
составлял 50 мл Посевной материал выращивали на среде
LB в течение 12-15
часов при скорости
качания 180 об/мин и температуре 370С.
Оптическую плотность (ОD) культуры измеряли фотометрически на КФК-3 при длине
волны 600 нм и выражали в оптических единицах (ОЕ).
Для индукции синтеза аспарагиназы
в колбы со средой LB и ампициллином вносили
посевной материал (ночная культура E. coli/ pET22b/HpA) и культуру выращивали до OD600 = 0,6 - 0,8 ОЕ. Затем в среду
добавляли – ИПТГ (изопропил-b-D-тиогалактопиранозид), в соответствующей концентрации (см.
ниже) и выращивание продолжали до достижения OD600 = 3,0 – 4,0 ОЕ.
Активность фермента определяли
методом прямой несслеризации [9], основанном на определении количества аммиака,
выделяющегося при катализируемом аспарагиназой гидролизе L-аспарагина. Для
этого суспензия клеток (10мкл) инкубируются в объеме 450 мкл с раствором L-аспарагина (30 мг/мл в 0,0125 М боратном буфере, рН
8,5) при 370С в течение 15-20 мин, после чего реакцию останавливают
внесением 250 мкл 20% раствора ТХУ. В плашечную лунку вносится 200мкл Н2О,
25мкл реакционной смеси после чего добавляется 25 мкл реактива Несслера. Контрольные
пробы содержат бактериальные клетки. Интенсивность окрашивания измеряли на Multiskan EX (Labsystems) при 492 нм. Концентрацию ионов аммония определяли по
калибровочному графику, который строили по хлориду аммония. За единицу
активности L-аспарагиназы (МЕ – международная единица) принимали такое
количество фермента, которое катализирует высвобождение 1 мкмоль аммиака за 1
мин при 370С.
Продуктивность культуры выражали в
единицах активности аспарагиназы в расчете на одну оптическую единицу плотности
культуры (МЕ/ОЕ).
Результаты и обсуждение. На сегодняшний день в литературе имеется мало
систематизированных экспериментальных данных по оптимизации условий культивирования
штаммов-продуцентов различных рекомбинантных белков. Удачное сочетание
традиционных методов оптимизации со специфическими подходами, применяемыми для
рекомбинантных штаммов, может значительно повысить выход конкретного целевого
продукта.
При
проведении оптимизации условий культивирования мы учитывали ряд технологических
параметров:
- различные штаммы продуценты E. coli;
- концентрацию индуктора (ИПТГ);
- температуру выращивания.
Как
известно, при экспрессии гетерологичных генов происходит метаболическое
истощение клетки, выражающееся в ингибировании клеточного роста, снижении
выхода биомассы и конечной продукции целевого белка [10]. С целью подбора оптимальных условий для получения
максимального количества микробной массы с высокой продуктивностью клеток был
проведен ряд экспериментов по определению концентрации индуктора и температуре
выращивания. Контроль продукции аспарагиназы осуществляли путем измерения
ферментативной активности.
В самом начале работы необходимо было
выбрать наиболее продуктивный штамм продуцент. Для этого оба штамма E. coli BL21(DE3) и E. coli BL21(DE3)pLysS выращивали при темпиратуре 37оС, индуктор
вносили до конечной концентрации 0,3мМ (рис.1).
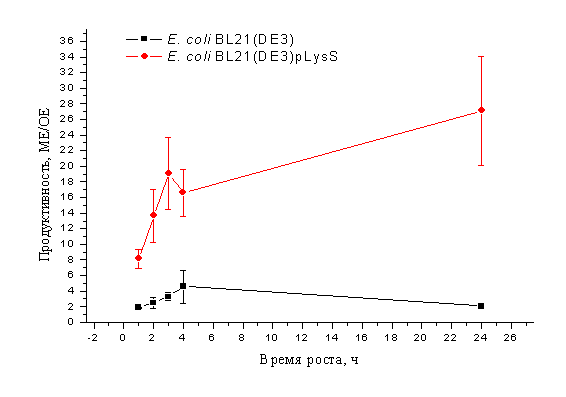
Рис.1
Выращивание культуры при t=37oC и концентрации ИПТГ 0,3мМ
Был построен график зависимости
продуктивности от времени роста для различных культур, температур и различной
концентраций индуктора. Как видно из графика (рис.1), продуктивность E. coli BL21(DE3) составляет в точках максимума не более 8
МЕ/ОЕ, в то время как E. coli BL21(DE3)pLysS дает продуктивность порядка 26 МЕ/ОЕ. Аналогичные
результаты получены и при других значениях концентрации индуктора и температуры
выращивания. Поэтому для проведения дальнейших исследований мы выбрали наиболее
продуктивный штамм E. coli BL21(DE3)pLysS.
Следующим параметром в нашем исследовании
была температура вырашивания. Для этого культуру выращивали при трех различных
температурах 25, 30 и 37оС (рис. 2). Из графика видно, что уже после
3 часов выращивания максимальная продуктивность достигается при температуре
25°C. По-видимому, это можно объяснить тем, что фермент L-аспарагиназа является
токсичным для самих клеток-продуцентов. При выращивании при температуре 25оС
скорость роста культуры снижается, что, вероятно, дает возможность клеткам
адаптироваться к новым условиям.
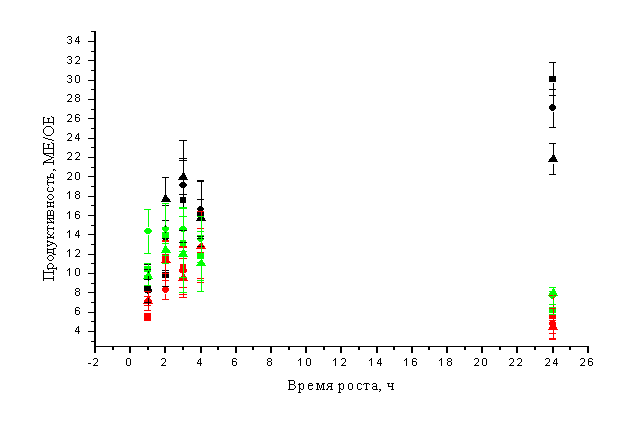 Рис.2. Выращивание штамма-продуцента E. coli BL21(DE3)pLysS при
различных температурах и концентрациях ИПТГ (концентрация ИПТГ: ■-0,1мМ,
●- 0,3мМ, ▲-1мМ; температура: черным цветом – 25оС, красным 30оС, зеленым
– 37оС.)
Рис.2. Выращивание штамма-продуцента E. coli BL21(DE3)pLysS при
различных температурах и концентрациях ИПТГ (концентрация ИПТГ: ■-0,1мМ,
●- 0,3мМ, ▲-1мМ; температура: черным цветом – 25оС, красным 30оС, зеленым
– 37оС.)
В процессе культивирования продуцентов E. coli/ pET22b/HpA индуктор (1М
раствор ИПТГ) вносили до конечной концентрации 1, 0,3
или 0,1 мМ. Результаты изучения влияния концентрации индуктора на
продуктивность штаммов представлены также на рис. 2. Как видно, после
добавления ИПТГ в различных концентрациях наблюдается чередование
периодов повышения
и снижения продуктивности клеток. Это
может быть связано либо с адаптацией клеток в ответ на индукцию ИПТГ, либо
являться артефактом, обусловленным
диауксией. Анализ зависимости
продуктивности от концентрации индуктора при различных температурах не выявил
явного преимущества какой-либо из концентраций.
Таким образом в нашем исследовании максимальная
продуктивность клеток (около 30 МЕ/ОЕ)
определяется через 24 часа после добавления индуктора в концентрации 0,1 мМ при
температуре выращивания 25оС. Однако около
70% от этой продуктивности определяется уже через 3 часа после добавления ИПТГ
в концентрации 1мМ при температуре выращивания 25оС.
Подводя итог
проделанной работе, можно сделать следующие выводы:
-
штамм E. coli BL21(DE3)pLysS оказался
более продуктивным, чем штамм E. coli BL21(DE3);
-
выращивание
культуры при температуре 25оС позволяет достичь высокой
продуктивности клеток - около 30МЕ/ОЕ;
-
продуктивность
культуры практически не зависит от концентрации внесенного в среду ИПТГ.
Литература:
1.
Н.Н.
Соколов, В.А. Занин, С.С. Александрова. Вопр. мед. химии., 46, 531-548 (2000).
2.
H.J. Muller, J. Boos, Crit. Rev. Oncol. Hematol., 28, 97-113(1998).
3.
Y. Perel, A. Auvrignon, T. Leblanc, et al., J. Clin.
Oncol., 20, 2774-2782 (2002).
4.
N.L. Kobrinsky, R. Sposto, N.R. Shah, et al., J. Clin.
Oncol., 19, 2390-2396 (2001).
5.
C.W. Taylor, R.T. Dorr, P. Fanta, et al., Cancer
Chemother. Pharmacol., 47, 83-88 (2001).
6.
G. Ollenschlager, E. Roth, W. Linkesch, et al.,
Eur. J. Clin. Invest., 18(5), 512-516 (1988).
7.
Н.Н.
Соколов, М.А. Эльдаров, К.В. Сидорук и др., Молек. мед., №1, 45-53 (2005).
8.
M. Vellard, Current Opinion in Biotechnol., 14., 1-7 (2003).
9.
H.E. Wade, B.P. Philips, Anal. Biochem., 72, 248 (1971).
10.
W.E. Bentley,
R.H. Davis, D.S. Kompola, Biotechnol. Bioeng.,
38, 749-760 (1991).