Медицина / 7.
К.т.н. Родионов И.В.
Саратовский государственный технический
университет
Научные подходы к созданию биосовместимых
имплантационных материалов
В современной медицине широко применяются и исследуются биотехнические
изделия и системы, в которых различные элементы и части взаимодействуют с
биологическими жидкостями, мягкими и твердыми тканями организма. Это относится,
в первую очередь, к изделиям, предназначенным для сердечно-сосудистой хирургии,
ортопедии, стоматологической и реконструктивной хирургии, офтальмологии [1,2].
Материалы данных изделий должны обладать определенным комплексом биологических,
физико-химических, медико-технических свойств, придающих им заданный уровень
совместимости с биосредой. Исследования в области биомедицинских материалов и
технологий ведутся в нескольких основных направлениях [3]:
- изучение процессов взаимодействия материалов с
биологическими жидкостями и тканями,
- разработка методов получения материалов и покрытий с
заданными параметрами биосовместимости,
- создание количественных методов оценки свойств
биосовместимых материалов и изделий,
- совершенствование методов
экспериментально-клинического применения изделий из биосовместимых материалов.
Наибольшее
значение в повышении эффективности процессов диагностики, терапевтического и
хирургического лечения, восстановления функций либо замены органов, реабилитации
пациентов имеет разработка методов получения материалов и покрытий, а также
изделий, обладающих качествами биологической и механической совместимости. К
медико-техническим изделиям, широко применяемым в указанных целях, относятся
шовные нити, искусственная кожа, катетеры, трубки, протезы сосудов, клапаны
сердца, кардиостимуляторы, мешки для крови, суставные эндопротезы, костные
остеофиксаторы, стоматологические имплантаты, офтальмологические линзы и
протезы. Эти медико-технические изделия могут взаимодействовать с кровью,
лимфой, тканевой жидкостью, слюной, в отдельных случаях с желчью, желудочным
соком и, кроме того, испытывать действие механических нагрузок.
Необходимая биосовместимость изделий в
данных условиях достигается, в основном, за счет применения определенных
металлических и неметаллических материалов. Они не должны вызывать иммунных
реакций биосреды и организма, кроме того, их способность сохранять требуемые
качества должна обеспечивать заданное функционирование изделий.
Биологическая совместимость материалов
обусловлена определенным уровнем их биологических и физико-химических свойств,
к которым относятся токсичность, стимулирование опухолеобразования, воздействие
на кровь, стерилизуемость, рентгеноконтрастность, а также электрические,
магнитные, оптические, химические свойства. Механическая совместимость
определяет такое поведение изделий под действием функциональных механических
нагрузок, которое не создает в биосреде механических повреждений, резорбции или
некроза [4,5].
Биосовместимые металлы и сплавы могут
подвергаться электрохимическому воздействию биосреды с опасностью их коррозии и
появления металлоза прилегающих тканей. Органические полимеры в этих условиях
могут приобретать структурные изменения за счет реакций водопоглощения и
гидролиза с переходом продуктов распада в окружающую биосреду. Неорганические
полимеры обладают физико-химической стойкостью, но могут иметь пониженную обрабатываемость
и недостаточный уровень механических свойств. Поэтому в зависимости от
характера биосовместимости материалов среди них выделяют биотолерантные,
биоинертные и биоактивные (рис.).
Биотолерантные
и биоинертные материалы, окруженные биосредой, с большей или меньшей
активностью адсорбируют на своей поверхности протеины плазмы крови и волокна
фибрина, образующие затем слой фиброзной ткани соответствующей толщины. Этот
слой ограничивает плотность формирующихся структур мягких либо твердых
биотканей на поверхности материала и не обеспечивает высокой стабильности
функционирования изделия в биосреде. Данные условия сдерживают применение таких
материалов, к которым относятся титан, тантал, цирконий, нержавеющие стали,
кобальтохромовые сплавы, корундовая и углеродная керамика, полиэтилен,
полиэтилентерефталат, полиметилметакрилат, политетрафторэтилен.
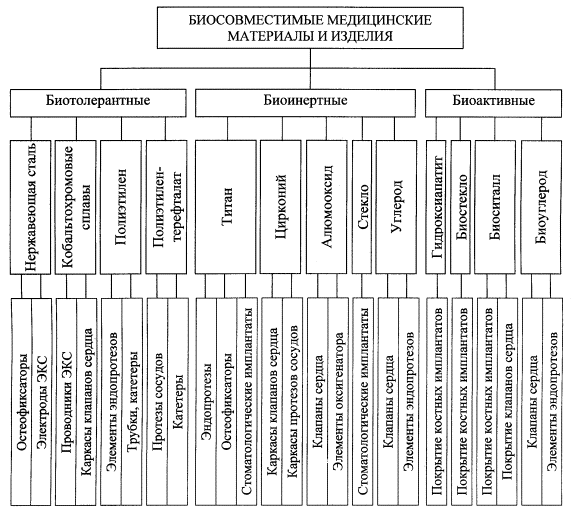
Рис. Применение в медицине биосовместимых
материалов и изделий
Биоактивность
материалов оказывает наиболее благоприятное влияние на их взаимодействие с
биосредой. На поверхности таких материалов адсорбируется тонкий слой аморфных
белковых структур, через который обеспечивается физико-химическая связь
материала со средой. В этих условиях происходит ионизация атомов биоактивного материала
и диффузия образовавшихся ионов в аморфный слой и биосреду. За счет протекания
биоэлектрохимических реакций развивается деструкция материала, и в образующиеся
несплошности происходит прорастание биоструктур окружающей среды, так что в
результате формируется биотехническая система «изделие – биосреда» [6]. Этим
достигается высокая стабильность положения изделия и эффективность его функционирования
в организме. Приведенные качества биоактивности проявляют материалы, включающие
некоторые биоинертные органические полимеры, кальцийфосфатные соединения,
биостекла, биоситаллы, углеродные материалы.
Особенно
важное значение имеет биоактивность материалов при изготовлении и применении
имплантатов значительных сроков действия, используемых в сердечно-сосудистой,
стоматологической и ортопедической хирургии. Так, приживление и функционирование
искусственных клапанов сердца, сосудов, стоматологических имплантатов,
эндопротезов в существенной степени зависит от нормального заживления имплантационной
раны и протекания дальнейших процессов в зоне контакта имплантата с биосредой.
Большую роль в этих условиях играют явления свертывания крови, представляющие несколько
сложных стадий протеиновых реакций с коагуляцией тромбоцитов, образованием
фибрина и кровяного сгустка [7]. Данные процессы обусловливают быстрое
заживление раны, но могут отрицательно сказываться на последующем
функционировании имплантата. При взаимодействии стенок искусственных сосудов и
клапанов сердца с потоком крови может возникать его турбулизация, опасность
оседания тромбоцитов на стенках и образования тромба. На поверхности костных
имплантатов в этих условиях может создаваться слой фиброзной ткани,
ограничивающий трофику прилегающей кости и процессы остеогенеза. Это
препятствует образованию плотных костных структур и остеоинтеграции имплантата,
стабилизирующей его положение и функционирование. В результате появляется
опасность смещения имплантата, возникновения воспалительных процессов и его
отторжения.
Предотвращение указанных явлений и
формирование биоактивных свойств материалов достигается за счет создания их
определенного химического состава, молекулярного строения и фазово-структурного
состояния. При этом поверхностным структурам материалов придается
морфологическая гетерогенность и пористость, что увеличивает фактическую
площадь контакта материала с биосредой и усиливает механический эффект сцепления
в контактной зоне. Кроме этого, такая поверхность обладает повышенным запасом
свободной энергии и, следовательно, уровнем химической активности, что ускоряет
процесс деструкции материала и проникновения биоструктур в его несплошности.
Вышеназванные биоактивные
материалы с приведенными поверхностными
характеристиками получают при помощи довольно сложных технологических
процессов. Механические свойства этих материалов оказываются на невысоком
уровне, что ограничивает их применение для изготовления имплантатов
стоматологического и ортопедического назначения, испытывающих значительные
механические нагрузки. Поэтому данные материалы часто используют для создания
биоактивных покрытий на имплантатах из титана, циркония, никелида титана,
имеющих биоинертные свойства [8]. Технологические методы получения биоактивных
покрытий включают золь-гелевые процессы, прессование и спекание материалов,
вакуумно-конденсационное и газотермическое напыление. Существенными
технико-экономическими достоинствами среди названных методов обладает способ
плазменно-дугового напыления, позволяющий получать покрытия из различных
биосовместимых материалов с заданными качествами биоактивности на имплантатах
сложной формы [9].
В последние годы развиваются
исследования, связанные с влиянием электрического заряда диэлектрических
имплантационных материалов на повышение характеристик их биоактивности, в
частности, за счет придания им тромборезистентности. При этом учитывается
наличие природного отрицательного заряда клеток тромбоцитов, что дает возможность
использовать методы электризации диэлектрических биоактивных материалов и покрытий
для придания им электретного (заряженного) состояния с монополярным отрицательным
зарядом, обеспечивающим тромборезистентность. [10]. Это позволяет исключить
опасность тромбообразования, значительно улучшить трофику кости и процессы
остеогенеза, а также снизить до минимума вероятность отторжения имплантатов. Данный
метод используется в кардиохирургической практике для создания
отрицательно-монополярного электретного состояния искусственных клапанов сердца
из стеклоуглерода с высоким уровнем тромборезистентности [11].
Костные титановые имплантаты с электретным танталооксидным покрытием
исследовались в лабораторных экспериментах и прошли клинические испытания на
подопытных животных, а также с участием пациентов. При этом было отмечено
значительное сокращение сроков остеоинтеграции имплантатов, восстановления нормальных
функций костных структур, окончательной реабилитации организма [12].
Применяемые титановые стоматологические
имплантаты с плазмонапыленными биопокрытиями обусловливают значительную
продолжительность приживления в костной ткани челюсти, составляющую 4-6
месяцев. При этом доля случаев послеоперационного отторжения имплантатов
достигает 3-4% [13]. Проведенные в Саратовском государственном техническом
университете исследования свойств плазмонапыленных гидроксиапатитовых покрытий
на титановых стоматологических имплантатах, а также параметров пленки нестехиометрического
диоксида титана, полученной при электрохимическом оксидировании титановых
имплантатов, показали, что данные покрытия имеют регулируемую долю структурных
и молекулярных несплошностей [14]. В процессе электризации таких покрытий
воздействием сильных электрических полей, коронного разряда в среде углекислого
газа, а также потока электронов указанные микронесплошности могут играть роль
«электронных ловушек», способствующих эффективному формированию отрицательного
монополярного заряда и созданию электретного состояния [15]. Подобное
физическое состояние диэлектрических биопокрытий значительно повышает их
биоактивность за счет действия на окружающую биоткань слабого внешнего
электрического поля и стимулирования протекания ряда биофизических и
биохимических реакций. При этом «замороженный» в диэлектрике электрический
заряд может способствовать развитию на отрицательно-монополярной поверхности
материала интенсивных сорбционных процессов по отношению к витаминам,
протеинам, антибиотикам, что ускоряет остеоинтеграционный и реабилитационный
периоды, ведет к сокращению сроков приживления имплантатов до 1-2 месяцев.
Электризация биосовместимых диэлектриков является новым научно-производственным направлением в создании современных биоактивных материалов, обладающих комплексом ранее неизученных электрических свойств. Разработка и совершенствование специализированного исследовательского оборудования, использование наукоемких технологий открывают перспективы значительного роста эффективности применения в медицине электретных биодиэлектриков.
Литература
1. Вильямс Д.Ф., Роуф Р. Имплантаты в
хирургии / Пер. с англ. М.: Медицина, 1978. 552 с.
2. Севастьянов В.И. Биосовместимые
материалы медицинского назначения. – Перспективные материалы. 1995. №5. С.
41-55.
3. Протасова Н.В., Лясникова А.В. Внутрикостные стоматологические имплантаты. 3-е изд. перераб. Саратов: Изд-во Сарат. техн. ун-та, 2001, 115 с.
4. Бейдик О.В., Бутовский К.Г., Лясников В.Н., Левченко К.К., Цыплаков А.Ю. Экспериментальное исследование процессов остеоинтеграции имплантаов для наружного чрескостного остеосинтеза с различными биокомпозиционными покрытиями. – Гений ортопедии. 2002. №4. С. 80-88.
5. Бутовский К.Г., Протасова Н.В. Материалы, используемые в производстве дентальных имплантатов // Современные проблемы имплантологии: Сборник научных статей по материалам 6-й Международной конференции. Саратов, 2002. С. 21-29.
6. Параскевич В.Л. Дентальная
имплантология. Основы теории и практики. – Минск: Юнипресс, 2002. 368 с.
7. Искусственные органы / Под ред. В.И.
Шумакова. – М.: Медицина, 1995. 214 с.
8. Лясников В.Н., Лепилин А.В., Бутовский К.Г., Лясникова А.В. Биомедицинские материалы в имплантационных системах ХХI века // Современные проблемы имплантологии: Сборник научных статей по материалам 7-й Международной конференции. Саратов, 2004. С. 7-15.
9. Калганова С.Г., Лясников В.Н. Научные основы создания современных дентальных имплантатов с биоактивным покрытием // Новое в стоматологии. Спец. вып. «Имплантаты в стоматологии». 1999, № 2. С. 24-28.
10. Гольдаде
В.А., Пинчук А.С. Электретные пластмассы: физика и материаловедение. – Минск:
Наука и техника, 1987. 231 с.
11. Сесслер Г.М. Электреты / Пер. с
англ. А.Ю. Гросберга. – М.: Мир. 1983.
12. http://electret.narod.ru/chelhir.htm
13. Лясников В.Н., Верещагина Л.А. Биологически активные плазмонапыленные покрытия для имплантатов // Перспективные материалы. 1996. № 6. С. 50-55.
14. Родионов И.В. Влияние окисления титана на свойства плазмонапыленных
титан-гидроксиапатитовых и оксидных биосовместимых покрытий дентальных
имплантатов. Автореф. дисс. канд. техн. наук. Саратов. 2004.
15. Губкин А.Н. Электреты. – М.: Наука. 1978. 192 с.