Физика/1.
Теоретическая физика.
К.х.н. Фёдоров С.В.
Санкт-Петербургский
государственный политехнический университет, Россия.
Уравнение изобарной теплоемкости веществ
в параметрической форме
Важным аргументом в пользу
фундаментального характера исследуемого уравнения служат вытекающие из него следствия, подтвержденные экспериментом.
В этой связи в работе [1]
рассматривался вопрос о принципиальной необходимости соответствия преложенного уравнения энтропии
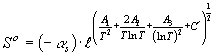 (А1, А2, А3
– const; c` -
параметр) (1) фундаментальному соотношению
(А1, А2, А3
– const; c` -
параметр) (1) фундаментальному соотношению
![]() ,
(2) вытекающему из
феноменологической теории термодинамики, т.е. рассматривалось требование
получения общего вида функции изобарной теплоемкости из (2) посредствам дифференцирования функции (1) по
температуре. Из результата дифференцирования (1) согласно (2) получили
уравнение изобарной теплоемкости
,
(2) вытекающему из
феноменологической теории термодинамики, т.е. рассматривалось требование
получения общего вида функции изобарной теплоемкости из (2) посредствам дифференцирования функции (1) по
температуре. Из результата дифференцирования (1) согласно (2) получили
уравнение изобарной теплоемкости
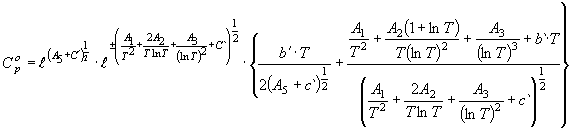 (3) где c` есть функция
температуры
(3) где c` есть функция
температуры
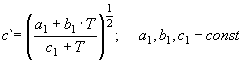 , (4)
производную, которой по температуре Т можно приближенно представить зависимостью
, (4)
производную, которой по температуре Т можно приближенно представить зависимостью ![]() . Надежность уравнения (3) подтверждена расчетами, согласующимися с
экспериментальными данными литературных источников [2-4]. Приведем уравнение (1) к виду
. Надежность уравнения (3) подтверждена расчетами, согласующимися с
экспериментальными данными литературных источников [2-4]. Приведем уравнение (1) к виду
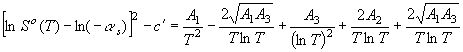 ,
(5)
,
(5)
из
которого вытекает ![]() (6) или
(6) или
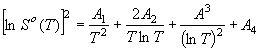 , (7) где
, (7) где
![]() (8)
(8)
На базе
уравнения (6), рассматривая систему четырех линейных уравнений, находим
значения величин ![]() . В равенстве (8) введем замену
. В равенстве (8) введем замену
![]() (9) получим
(9) получим
![]() (10) откуда
(10) откуда
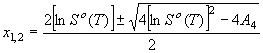 (11)
Подставляя х1,2 в (9),
имеем
(11)
Подставляя х1,2 в (9),
имеем ![]() или
или
![]() (12) Принимая в (12)
(12) Принимая в (12) ![]() , получим
, получим
![]() (13) Учитывая, что величина
(13) Учитывая, что величина ![]() имеет размерность
теплоемкости (см.(1)) её можно
отождествить с изобарной теплоемкостью
и на основании (13) запишем
имеет размерность
теплоемкости (см.(1)) её можно
отождествить с изобарной теплоемкостью
и на основании (13) запишем 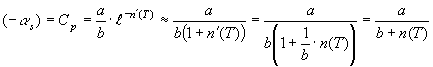 или
или
![]() ,
(14) где
,
(14) где
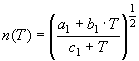 ;
;![]()
![]() (15)
Решая (15) относительно температуры (Т), необходимо рассмотреть шесть возможных
вариантов:
(15)
Решая (15) относительно температуры (Т), необходимо рассмотреть шесть возможных
вариантов:
1. 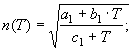
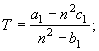
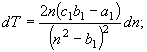
![]() (16)
(16)
2. 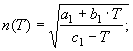
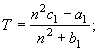
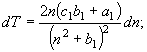
![]() (17)
(17)
3. 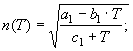
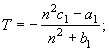
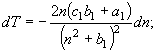
![]() (18)
(18)
4. 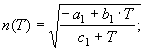
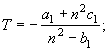
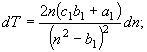
![]() (19)
(19)
5. 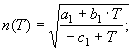
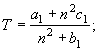
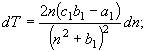
![]() (20)
(20)
6. 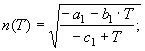
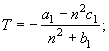
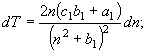
![]() (21) Равенствам (16) согласно соотношению между изобарной
теплоемкостью и энтропией (2) отвечает функция энтропии вида
(21) Равенствам (16) согласно соотношению между изобарной
теплоемкостью и энтропией (2) отвечает функция энтропии вида
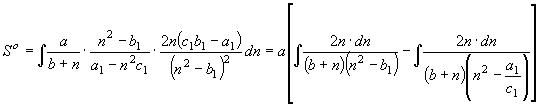 , (22) где
, (22) где ![]() .
.
С другой стороны система равенств (17), (18), (21)
сочетается с функцией энтропии
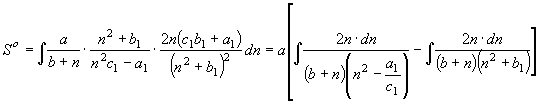 , (23)
где
, (23)
где ![]() . Системам равенств
(19) и (20) отвечают функции энтропии
(24), (25) соответственно.
. Системам равенств
(19) и (20) отвечают функции энтропии
(24), (25) соответственно.
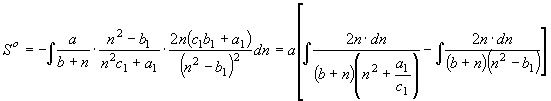 , (24) где
, (24) где ![]() .
.
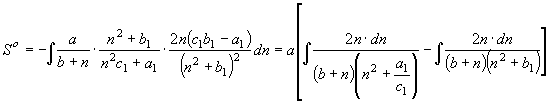 , (25) где
, (25) где ![]() .
.
Рассмотрим
наипростейший случай нахождения энтропии, когда на данном интервале ![]() значений n, функция
значений n, функция ![]() , принимая некоторое среднее значение, остается на данном
интервале величиной постоянной, т.е.
, принимая некоторое среднее значение, остается на данном
интервале величиной постоянной, т.е. ![]() . В этом случае согласно интегралов (22) – (25) вытекают соответствующие функции энтропии:
. В этом случае согласно интегралов (22) – (25) вытекают соответствующие функции энтропии:
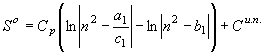 ;
; ![]() (26)
(26)
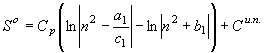 ;
; ![]() (27)
(27)
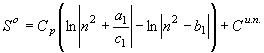 ;
; ![]() (28)
(28)
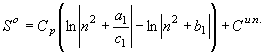 ;
; ![]() (29) Для нахождения общего вида функции энтропии,
в выше рассмотренных случаях (22) – (25) преобразуем их:
(29) Для нахождения общего вида функции энтропии,
в выше рассмотренных случаях (22) – (25) преобразуем их:
согласно (22) имеем
![]()
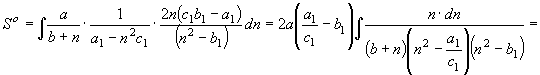
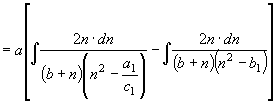 ;
; ![]() (30) По аналогии с преобразованием уравнения
(22) запишем в преобразованном виде уравнения (23) – (25) соответственно
(30) По аналогии с преобразованием уравнения
(22) запишем в преобразованном виде уравнения (23) – (25) соответственно
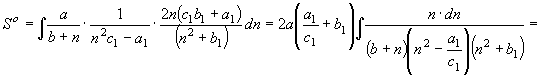
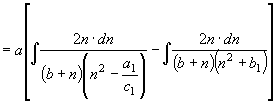 ;
; ![]() (31)
(31)
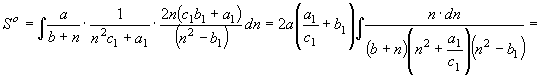
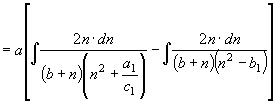 ;
; ![]() (32)
(32)
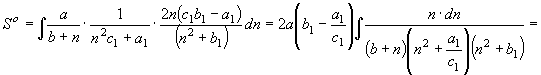
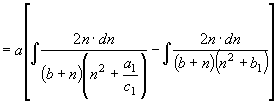 ;
; ![]() (33)
(33)
Чтобы воспользоваться уравнениями (30) –
(33), необходимо найти интегралы правой части этих равенств. С этой целью
преобразуем их подынтегральные выражения. Метод преобразований рассмотрим на
примере преобразования подынтегрального выражения первого интеграла правой
части равенства (30).
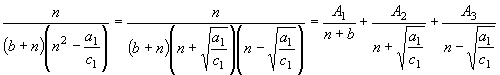 (34) Приведя слагаемые в правой части
(34) к общему знаменателю и сгруппировав подобные члены числителя,
приходим к трем линейным уравнениям
(34) Приведя слагаемые в правой части
(34) к общему знаменателю и сгруппировав подобные члены числителя,
приходим к трем линейным уравнениям
1).
![]() (35)
(35)
2). 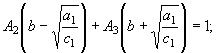 (36)
(36)
3). 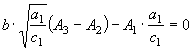 (37)
(37)
Левая часть уравнения (35) является
коэффициентом при переменной ![]() , которая в числителе
левой части равенства (34) отсутствует, поэтому коэффициент приравнивается нулю. Левая часть уравнения (36) является
коэффициентом при переменной n левой части уравнения (34), которая равна единице.
Третье уравнение связано со свободным членом числителя равенства (34), который
равен нулю.
, которая в числителе
левой части равенства (34) отсутствует, поэтому коэффициент приравнивается нулю. Левая часть уравнения (36) является
коэффициентом при переменной n левой части уравнения (34), которая равна единице.
Третье уравнение связано со свободным членом числителя равенства (34), который
равен нулю.
Решая совместно уравнения (35) – (37),
находим
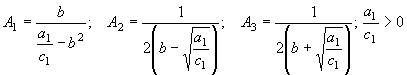 (38) По аналогии с преобразованиями подынтегрального выражения
первого интеграла правой части равенства (30) преобразуем подынтегральное выражения
второго интеграла этого равенства. В результате преобразований получим систему
трех равенств, аналогичных равенствам (35) – (37), в которых достаточно
заменить отношение
(38) По аналогии с преобразованиями подынтегрального выражения
первого интеграла правой части равенства (30) преобразуем подынтегральное выражения
второго интеграла этого равенства. В результате преобразований получим систему
трех равенств, аналогичных равенствам (35) – (37), в которых достаточно
заменить отношение ![]() величиной b1, т.е.
имеем
величиной b1, т.е.
имеем
1). ![]() (39)
(39)
2). ![]() (40)
(40)
3). ![]() (41) Решая совместно (39) – (41), получим
(41) Решая совместно (39) – (41), получим
![]() (42) Аналогичные
преобразования проведем с подынтегральными выражениями функций (31) –
(33).
(42) Аналогичные
преобразования проведем с подынтегральными выражениями функций (31) –
(33).
I. 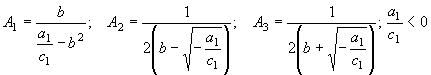 (43)
(43)
![]()
II. 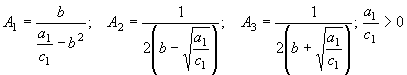 (44)
(44)
![]()
III. 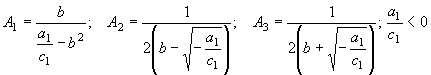 (45)
(45)
![]()
Системы
равенств (43) – (45) можно объединить, используя абсолютные значения
подкоренных выражений.
IV. 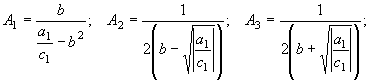 (46)
(46)
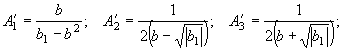
Заменяя
подынтегральное выражение первого интеграла правой части равенства (30) суммой (34) с учетом найденных выражений ![]() из системы (46) имеем
из системы (46) имеем
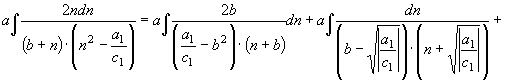
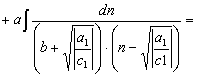
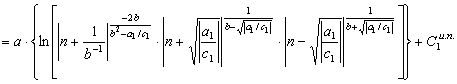 (47) По аналогии преобразуем второй интеграл правой части равенства (30)
(47) По аналогии преобразуем второй интеграл правой части равенства (30)
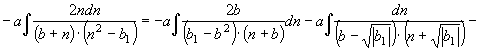
![]()
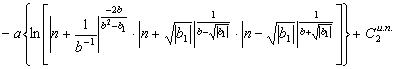 (48) Объединяя
интегралы (47) и (48), найдем общий вид уравнения энтропии
(48) Объединяя
интегралы (47) и (48), найдем общий вид уравнения энтропии
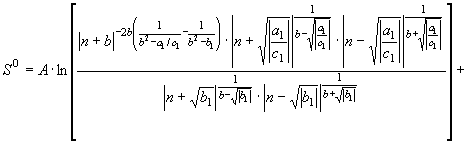
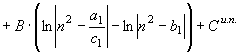 (49)
(49)
Рассмотрим один из вариантов функции
высокотемпературной составляющей энтальпии вещества, для которой согласно
равенств (16), можно записать
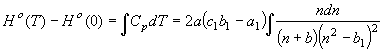 (50) Наипростейшему случаю функции высокотемпературной составляющей на
исследуемом интервале
(50) Наипростейшему случаю функции высокотемпературной составляющей на
исследуемом интервале ![]() отвечает изобарная
теплоемкость
отвечает изобарная
теплоемкость ![]() :
:
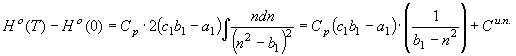 (51) Аналогичные уравнения высокотемпературных составляющих энтальпии
можно найти на базе систем уравнений (17) – (20). В общем случае функция высокотемпературных
составляющих энтальпии вещества находится из преобразования интеграла (50).
Рассмотрим это преобразование:
(51) Аналогичные уравнения высокотемпературных составляющих энтальпии
можно найти на базе систем уравнений (17) – (20). В общем случае функция высокотемпературных
составляющих энтальпии вещества находится из преобразования интеграла (50).
Рассмотрим это преобразование:
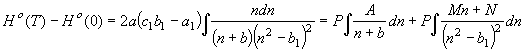 , (52)
где
, (52)
где ![]() связаны уравнением (15)
a, b – уравнением
(14). Первый интеграл правой части (52)
связаны уравнением (15)
a, b – уравнением
(14). Первый интеграл правой части (52)
![]() (53)
(53)
Второй
интеграл правой части (52)
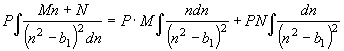 , (54) где
, (54) где
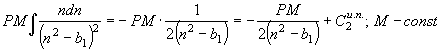 (55)
(55)
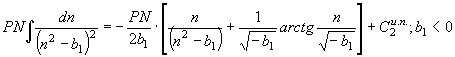 (56) Введем в (53) – (56) обозначения
(56) Введем в (53) – (56) обозначения
![]() , следовательно, уравнение (50) приводится к виду
, следовательно, уравнение (50) приводится к виду
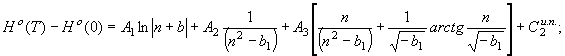 (57) В
равенстве (57) предполагается, что b1<0; в
случае b>0 его нужно представить
(57) В
равенстве (57) предполагается, что b1<0; в
случае b>0 его нужно представить
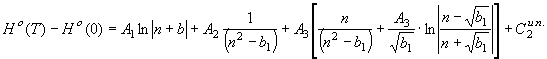 , (58)
, (58)
Общий
вид функции энтропии вещества вытекает из преобразований уравнения (30)
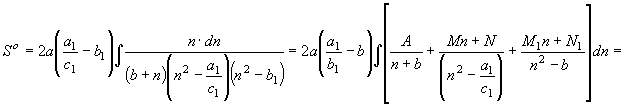
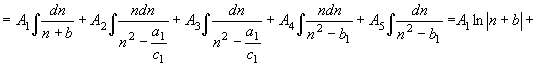
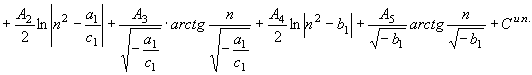 , (59) где
, (59) где 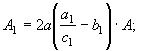
![]()
![]()
![]()
![]()
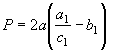
Равенство
(59) предполагает, что ![]() . Если
. Если ![]() , тогда
, тогда
равенство (59) примет вид
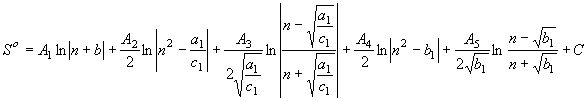 (60)
(60)
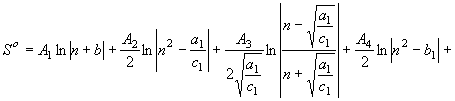
![]() ; при
; при ![]() ; (61)
; (61)
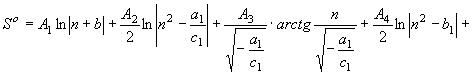
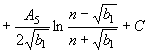 при
при ![]() (62)
(62)
Для твердой фазы алюминия ![]() нашли функцию
энтропии от аргумента (n) на базе равенства (61)
нашли функцию
энтропии от аргумента (n) на базе равенства (61)
![]()
![]() , (63) где
, (63) где
![]() ;
; ![]() .
.
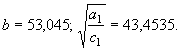
Высокотемпературную
составляющую энтальпии твердой фазы алюминия найдем на базе уравнения (57)
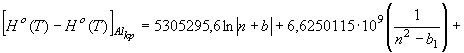
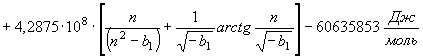 (64) где
(64) где ![]()
![]()
Результаты расчета энтропии,
высокотемпературной составляющей энтальпии и изобарной теплоемкости
кристаллического алюминия по уравнениям (63), (64) и (75) приведены в таблице 1
в сопоставлении с данными литературных источников [2].
Таблица 1.
|
ТК |
n |
(63) |
[2] |
(64) |
[2] |
(74) |
[2] |
|
Дж/моль·К |
Дж/моль |
Дж/моль·К |
|||||
|
200 |
44,116 |
19,4 |
19,179 |
2286 |
2301 |
|
|
|
300 |
44,455 |
28,7 |
28,501 |
4648 |
4610 |
24,619 |
24,354 |
|
400 |
44,8 |
35,9 |
35,703 |
7132 |
7117 |
25,637 |
25,687 |
|
500 |
45,1517 |
41,7 |
41,547 |
9739 |
9738 |
26,811 |
26,759 |
|
600 |
45,51 |
46,6 |
46,531 |
12478 |
12473 |
28,085 |
27,973 |
|
700 |
45,875 |
50,8 |
50,948 |
15357 |
15340 |
29,424 |
29,415 |
|
800 |
46,247 |
54,8 |
54,984 |
18386 |
18365 |
31,13 |
31,13 |
|
900 |
46,627 |
58,8 |
58,764 |
21575 |
21576 |
32,976 |
33,138 |
|
933 |
46,754 |
59,9 |
59,992 |
22662 |
22702 |
33,649 |
33,881 |
Для жидких фаз алюминия, фосфора и серы с учетом
постоянства их изобарных теплоемкостей найдены функции:
для жидкой фазы алюминия
![]() ; (65)
; (65)
![]() (66)
(66)
![]()
для жидкой фазы фосфора
![]() (67)
(67)
![]() (68)
(68)
![]() (69)
(69)
для жидкой фазы серы
![]() ; (70)
; (70)
![]() (71)
(71)
![]() (72)
(72)
Функция
энтропии для жидкой фазы алюминия построена на базе уравнения (27), а функции
для энтропии жидких фаз фосфора и серы построены на базе уравнения (26).
Основные результаты расчета функций высокотемпературных составляющих энтальпии
(65), (67) и (70), а также функции энтропии (66), (68) и (71) приведены в
сопоставлении с данными литературных источников [2] в таблице 2.
Таблица
2.
Значения функций высокотемпературных составляющих
энтальпии и энтропии для жидких фаз алюминия, сопоставленные с данными
литературных источников [2].
|
ТК |
n |
(66) |
[2] |
(65) |
[2] |
|
Дж/моль·К |
Дж/моль |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
1000 |
47,015 |
73,634 |
73,634 |
35519,48 |
35510 |
|
1500 |
49,0727 |
86,501 |
86,508 |
51384,79 |
51385 |
|
2000 |
51,36806 |
95,637 |
95,643 |
67260,03 |
67260 |
|
2500 |
53,952 |
102,725 |
102,727 |
83137,06 |
83135 |
|
3000 |
53,952 |
108,515 |
108,515 |
99011,04 |
99010 |
|
3500 |
56,893 |
113,407 |
113,41 |
114881,88 |
114885 |
|
4000 |
60,286 |
117,649 |
117,649 |
130760,02 |
130760 |
|
4500 |
64,268 |
121,393 |
121,389 |
146642,1 |
146635 |
Таблица 2 (продолжение 1)
Значения функций высокотемпературных составляющих
энтальпии и энтропии для жидких фаз фосфора, сопоставленные с данными
литературных источников [2].
|
ТК |
n |
(68)
|
[2] |
(67) |
[2] |
|
Дж/моль·К |
Дж/моль |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
320 |
29,747 |
44,883 |
44,883 |
6549 |
6549 |
|
420 |
28,2648 |
51,981 |
51,985 |
9161,2 |
9161,0 |
|
520 |
28,462 |
57,619 |
57,563 |
11783,32 |
11773 |
|
620 |
28,517 |
62,173 |
62,157 |
14397,45 |
14384 |
|
720 |
28,5427 |
66,066 |
66,062 |
16999,84 |
16996 |
|
820 |
28,558 |
69,608 |
69,458 |
19681,643 |
19608 |
|
900 |
28,5658 |
71,889 |
71,889 |
21702,853 |
21697 |
Таблица 2 (продолжение 2)
Значения функций высокотемпературных составляющих
энтальпии и энтропии для жидких фаз серы, сопоставленные с данными литературных
источников [2].
|
ТК |
n |
(70) |
[2] |
(71) |
[2] |
|
Дж/моль·К |
Дж/моль |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
700 |
36,426 |
65,249 |
65,249 |
19917 |
19917 |
|
800 |
37,108 |
69,57 |
69,619 |
23150 |
23189 |
|
900 |
37,4336 |
73,38 |
73,436 |
26339,4 |
26430 |
|
1000 |
37,925 |
76,804 |
76,834 |
29652 |
29654 |
|
1100 |
37,75 |
79,865 |
79,899 |
32814,7 |
32871,0 |
|
1200 |
37,83921 |
82,717 |
82,694 |
36100,47 |
36082 |
|
1300 |
37,905 |
85,262 |
85,262 |
39347 |
39291 |
В тех случаях, когда изобарная
теплоемкость является переменной величиной на данном интервале ![]() , энтропия связана с уравнением (49) и с системой равенств I – III или (43) – (45). Для кристаллического
алюминия на базе общих уравнений (14),
(15) и экспериментальных данных [2] нашли
, энтропия связана с уравнением (49) и с системой равенств I – III или (43) – (45). Для кристаллического
алюминия на базе общих уравнений (14),
(15) и экспериментальных данных [2] нашли
![]() , (см. (63)). По этим значениям рассчитали функции (46)
, (см. (63)). По этим значениям рассчитали функции (46)
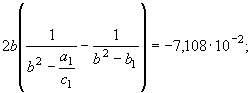
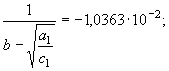
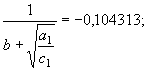
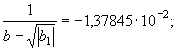
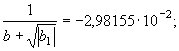 (73) Принимая во внимание параметрическое
уравнение для изобарной теплоемкости кристаллического алюминия
(73) Принимая во внимание параметрическое
уравнение для изобарной теплоемкости кристаллического алюминия
![]() ,
(74) а также значения
,
(74) а также значения 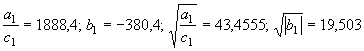 для энтропии
кристаллического алюминия в интервале
для энтропии
кристаллического алюминия в интервале ![]() согласно
уравнения (49), имеем
согласно
уравнения (49), имеем
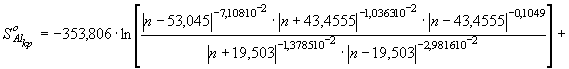
![]() (75)
(75)
По аналогии с
расчетом энтропии кристаллического алюминия провели расчеты кристаллической
фазы кремния по уравнениям
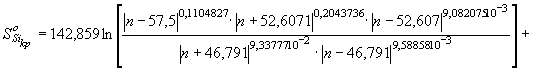
![]() (76)
(76)
![]()
![]() , (77) где
, (77) где
![]() ;
; ![]()
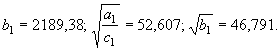
Результаты расчета энтропий
кристаллического алюминия и кремния по уравнениям (63), (75) и (76), (77)
соответственно приведены в таблице 3 в сопоставлении с данными литературных источников [2].
Таблица 3.
Расчетные
значения энтропий кристаллических алюминия и кремния по уравнениям (63), (75) и
(76), (77) соответственно в сопоставлении
с данными литературных источников [2].
|
|
|
||||||||
|
ТК |
n |
|
|
|
TK |
n |
|
|
|
|
Дж/моль К |
Дж/моль К |
||||||||
|
300 |
44,459 |
28,7 |
28,857 |
28,501 |
300 |
42,82 |
18,927 |
18,931 |
18,933 |
|
400 |
44,8 |
35,9 |
35,856 |
35,703 |
400 |
43,983 |
25,021 |
25,022 |
25,023 |
|
500 |
45,152 |
41,7 |
41,623 |
41,547 |
500 |
44,7437 |
30,166 |
30,159 |
30,152 |
|
600 |
45,51 |
46.6 |
46,539 |
46,531 |
600 |
45,18 |
34,5365 |
34,5367 |
34,537 |
|
700 |
45,875 |
50,8 |
50,874 |
50,948 |
700 |
45,463 |
38,316 |
38,316 |
38,316 |
|
800 |
46,247 |
54,8 |
54,97 |
54,984 |
800 |
45,6613 |
41,673 |
41,7125 |
41,752 |
|
900 |
46,627 |
58,8 |
58,782 |
58,764 |
900 |
45,808 |
44,596 |
44,699 |
44,802 |
|
933 |
46,754 |
59,9 |
59,946 |
59,992 |
933 |
|
|
|
|
В Ы В О Д Ы
1.
Дан вывод уравнения
изобарной теплоемкости веществ в параметрической форме (см.(14),(15)).
2.
Найдены уравнения
функции образования энтропии и высокотемпературных составляющих энтальпии
веществ в параметрической форме (см.(49), (57)-(61)).
3.
Сопоставлены результаты
расчета по уравнениям (63) и (75) значений энтропии кристаллического алюминия, а также рассчитанные по уравнениям
(76), (77) значения энтропии кристаллического кремния, которые в свою очередь
находятся в хорошем согласии с данными литературных источников [2] (см.табл.3).
4.
Оценены
термодинамические характеристики жидких фаз алюминия, фосфора и серы с помощью
параметрических уравнений (65)-(72), (см.табл. 1-2).
ЛИТЕРАТУРА
1.
Федоров С.В. Новые принципы расчета функций образования
термодинамических свойств веществ. СПб.
– изд. СПб ГПУ, 2008. – с. 303-329.
2.
В.П. Глушко, Л.В.
Гуревич, Г.А. Бергман и др. Термодинамические свойства индивидуальных веществ.
М. – Наука, 1978.
3.
В.А. Киреев. Методы
практических расчетов в термодинамике химических реакций. 2-ое изд., испр. и
доп. М., «Химия», 1975.
4.
В.А. Рябин, М.А.
Остроумов, Т.Ф. Свит. Термодинамические свойства веществ. Справочник. Л.,
«Химия» , 1977.