к. фарм. н. С.М. Куліш, Гушлевська Ю.С.
Синтез 5-(піридин-2-іл)-4R-1,2,4-тріазол-3-тіонів
та 2-[5-(алкіл-, гетерил-, арилтіо)-4R-1,2,4-тріазол-3-іл]піридинів
Запорізький
державний медичний університет
У якості вихідних речовин для синтезу S- алкіл-,
гетерил-, арилпохідних 1,2,4-тріазол-3-тіонів ми використовували 5-(піридин-2-іл)-2Н-1,2,4-тріазол-3-тіон та
4-феніл-5-(піридин-2-іл)-1,2,4-тріазол-3-тіон. Ці тіони ми отримали за
відомими в літературі методами.
Вихідними речовинами для синтезу 5-(піридин-2-іл)-2Н-1,2,4-тріазол-3-тіону
та 4-феніл-5-(піридин-2-іл)-1,2,4-тріазол-3-тіону ми використовували
2-піридинкарбонову кислоту, етерифікацією якої етиловим спиртом в присутності
сульфатної кислоти ми отримали етиловий
естер 2-піридинкарбонової кислоти.
При взаємодії етилового естеру 2-піридинкарбонової кислоти та гідразину гідрату в середовищі етанолу наи синтезовано
гідразид 2-піридин-карбонової кислоти.
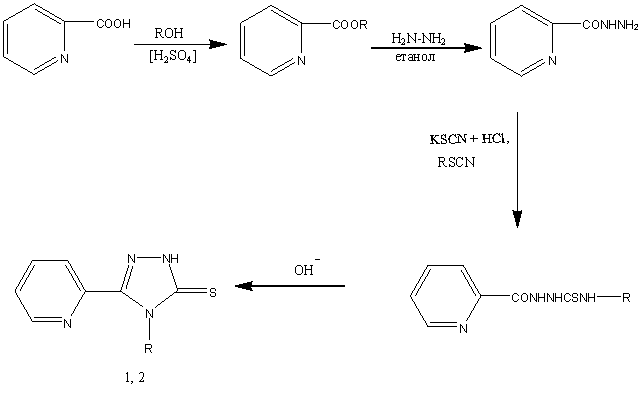
Останній вступає в реакцію з калію тіоцианатом в кислому середовищі з
утворенням 2-(2-піридил)-1-гідразинокарбтіоаміду або з фенілізотіоцианатом
в середовищі етанолу з утворенням відповідного 2-(2-піридин)-N-феніл-1-гідразинокарбтіоаміду (рис 1).
Вихідні сполуки 5-(піридин-2-іл)-2Н-1,2,4-тріазол-3-тіон та
4-фе-ніл-5-(піридин-2-іл)-1,2,4-тріазол-3-тіон отримані нами замиканням
тріазолового циклу в лужному середовищі (рис. 1).
ІЧ-спектр сполуки 1 характеризується чіткими смугами коливань NH-групи в межах 3500-3330 см–1, Слід зауважити, що у сполуки 2 відсутні смуги коливання NH-групи.
Сполук 1 та 2 мають чіткі смуги коливань груп C=N- в межа х 1660-1510 см–1, а також смуги коливання піридинового циклу при 1500-1480 см–1. Валентні коливання груп С=S
виявлені при 1220-1180 см–1. В ІЧ-спектрі сполуки 2 існує інтенсивні полоси коливання ароматичного кільця при
1480-1440 см–1 . З метою встановлення можливого
існування тіон-тіольної таутомерії були вивченні електронні спектри 5-(піридин-2-іл)-2Н-1,2,4-тріазол-3-тіону та
4-феніл-5-(піридин-2-іл)-1,2,4-тріазол-3-тіону.
R=H, C6H5
Рис. 1. Схема синтезу 5-(піридин-2-іл)-2Н-1,2,4-тріазол-3-тіону та
4-феніл-5-(піридин-2-іл)-1,2,4-тріазол-3-тіону
Тіони (1, 2) - білі кристалічні
речовини розчинні в розчинах лугів, мінеральних кислот та спиртах, а також в
диметилформаміді.
Для вирішення питання про напрям алкілування вищезгаданих тіонів нами проведено квантово-хімічні розрахунки
5-(піридин-2-іл)-2Н-1,2,4-тріазол-3-тіону та
4-феніл-5-(піридин-2-іл)-1,2,4-тріазол-3-тіону за методом Хюкеля. Результати квантово-хімічних
розрахунків наведені в табл. 1. Таблиця 1
Квантово-хімічні розрахунки
молекул 5-(піридин-2-іл)-2Н-1,2,4-тріазол-3-тіону та
4-феніл-5-(піридин-2-іл)-1,2,4-тріазол-3-тіону
|
|
|
||||
|
Атом |
Атомний заряд |
Атом |
Атомний заряд |
|
||
|
Сполука 2.6 |
Сполука 2.7 |
|
||||
|
N(1) |
-0,083 |
N(1) |
-0,071 |
|
||
|
C(2) |
0,155 |
C(2) |
0,138 |
|
||
|
N(3) |
-0,257 |
N(3) |
-0,206 |
|
||
|
C(5) |
0,644 |
C(4) |
0,649 |
|
||
|
N(6) |
-0,153 |
N(5) |
-0,155 |
|
||
|
S(14) |
-0,609 |
S(13) |
-0,668 |
|
||
Як видно з наведених в табл. 1
даних, що найбільшу електронну густину у молекулах 1,2,4-тріазол-3-тіонів (1,
2) мають атоми сірки -0,609 та -0,668 відповідно.
З наведених вище теоретичних розрахунків можна припустити, що алкілування
тіонів (1, 2) повинно проходити по атому сірки з утворенням відповідних S-похідних. Алкілування, арилювання, гетерилювання
5-(піри-дин-2-іл)-2Н-1,2,4-тріазол-3-тіону та
4-феніл-5-(піридин-2-іл)-1,2,4-тріазол-3-тіону галоїдними алканами, арилами,
гетероциклами (етилйодид, пропілйодид, ізопропілйодид, амілбромід, гептилйодид,
октилйодид, нонілйодид, децилхлорид, 2,4-динітрохлорбензол, 2-хлор-піридин)
проводились нами в середовищі етанолу в
присутності еквімолекулярної кількості натрій гідроксиду. Реакційну суміш
нагрівають до нейтрального середовища, фільтрують, розчинник випаровують (табл.
2.4, рис. 2.2).
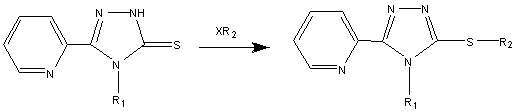
X= Cl, Br, I; R1=
H, феніл; R2= Alk, Ar, Het
Рис. 2. Схема алкілування, арилювання та гетерилювання
5-(піридин-2-іл)-2Н-1,2,4-тріазол-3-тіону та
4-феніл-5-(піридин-2-іл)-1,2,4-тріазол-3-тіону
Отримані, таким чином, речовини являють собою білі, жовті кристалічні
речовини мало розчинні в воді, крім 2-(5-(піридин-2-іл)-1H-1,2,4-тріазол-3-ілтіо)піридину
та 2-(4-феніл-5-(піридин-2-іл)-4H-1,2,4-тріазол-3-ілтіо)піридину. Всі сполуки
розчинні в органічних розчинниках. Для аналізу 3-(алкіл-, арил-, гетерилтіо)-5-(піридин-2-іл)-4R-1,2,4-тріазоли очищені
перекристалізацією із суміші етанол: вода, 1:1 та з суміші диметилформамід:
вода.
Індивідуальність сполук підтверджена нами за допомогою тонкошарової
хроматографії в різних системах розчинників.
ІЧ-спектри 5-(піридин-2-іл)-4R-1,2,4-тріазол-3-тіонів (1,
2) та 2-[5-(алкіл-, арил-, гетерилтіо)-4R-1,2,4-тріазол-3-іл]піридинів
характеризуються наявністю смуг поглинання C=N-груп
в межах 1690 – 1640 см-1, С-S-
груп в межах 600 – 520 см-1, піридинового циклу 1500-1490 см-1,
ароматичного кільця в межах 1480 – 1400 см-1 (похідних сполуки 2) та
NН-груп в межах 3500 – 3300 см-1 (похідних
сполуки 1). ІЧ-спектри вихідних речовин 5-(піридин-2-іл)-4R-1,2,4-тріазол-3-тіонів, ІЧ-спектри їх 3-(алкіл-, арил-, гетерил-)-похідних мають смуги поглинання при
2975 – 2845 см-1 і 1250 - 1175 см-1, що може свідчити про
наявність відповідно метильних або метиленових радикалів (рис. 3).
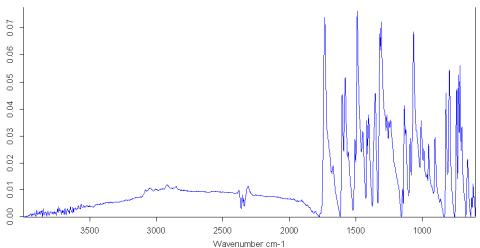
Рис. 3. ІЧ-спектр 2-(5-(гептилтіо)-4-феніл-4H-1,2,4-тріазол-3-іл)піридину
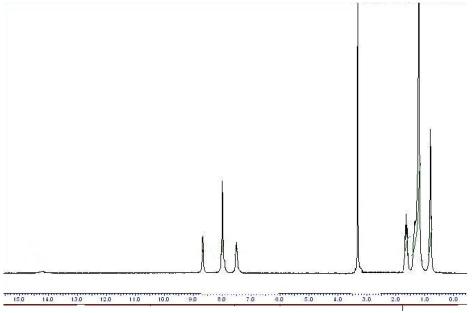
ПМР-спектр (рис. 4.) 2-(5-(октилтіо)-2H-1,2,4-тріазол-3-іл)піридину характеризується
наявністю сигналів протонів метильної групи (0.96 м.ч.), метиленових груп
(1.29, 1.33, 1.69 м.ч.), метиленової групи, зв’язаної з атомом сірки (3.12
м.ч.), протонів піридинового циклу (7.44, 7.97, 8.55, 8.81 м.ч.) та ароматичних
протонів фенільного радикалу (7.3 м.ч.).
Рис. 2.4. ПМР-спектр 2-(5-(октилтіо)-2H-1,2,4-тріазол-3-іл)піридину (2.13)
Література:
1. Бранд Дж. Применение спектроскопии в органической химии / Бранд Дж., Эглинтон
Г. – М. : Мир, 1967. – 280 с.
2. Вивчення фізико-хімічних та біологічних властивостей серед похідних
5-R-4-R1-1,2,4-тріазол-3-тіонів / Куліш С. М., Панасенко О. І., Книш Є. Г. [та
ін.] // Хист : Всеукр. мед. журн. молодих вчених. – 2007. – Вип. 9. – С. 157.
3. Казицына Л. А. Применение УФ-, ИК-, ЯМР- и МАСС-спектроскопии в
органической химии / Л. А. Казицына. – 2-е изд., перераб. и доп. – М. : Изд-во.
Моск. ун-та, 1979. – 236 с.
4. Куліш С. М. Алкілування, арилювання та гетерилювання
5-(піридин-2-іл)-4-R-1,2,4-тріазол-3-тіонів та їх біологічна активність / Куліш
С. М., Книш Є. Г., Панасенко О. І. // Медична хімія. – Тернопіль, 2006. – Т. 2
, вип. 8. – С. 112–114.
5. Куліш С. М. Антиоксидантні властивості солей
5-R-2Н-1,2,4-тріазоліл-5-тіоацетатних кислот / Куліш С. М., Панасенко Т. О.,
Павлов С. В. // Тези доп. до ІІІ Нац. з’їзду фармакологів України «Фармакологія
2006 – крок у майбутнє». – О., 2006. – С. 131.
6. Куліш С. М. Пошук біологічно активних речовин в ряду тіозаміщених
3-R-1,2,4-тріазол-5-тіону / Куліш С. М., Щербина Р. О., Пругло Є. С. // Тези
доп. до міжнар. студентської наук. конф. «Молодь - медицині майбутнього». – О.,
2006. – С. 73.
7. Куліш С. М. Синтез, хімічні перетворення, фізико-хімічні та біологічні
властивості серед похідних 5-R-1,2,4-тріазол-3-тіону та
4-феніл-5-R-1,2,4-тріазол-3-тіону / Куліш С. М., Маковік Ю. В., Парченко В. В.
// Матеріали до міжвуз. наук. конф. студентів та молодих вчених Івано-Франків.
держ. мед. ун-т : тези доп. – Івано-Франківськ, 2006. – С. 24.
8. Поиск биологически активных веществ среди
5-(гетерил)-4R-1,2,4-триазол-3-тионов / Кулиш С. Н., Парченко В. В., Панасенко
Т. А. [и др.] // Лекарства–человеку. Современные проблемы создания,
исследования и апробации лекарственных средств : материалы конф. (23 марта 2006
г.). – Х. : Изд-во НФаУ, 2006. – С. 94–95.
9. Пошук біологічно активних сполук серед похідних 5-R-1,2,4-тріазол-3-тіону
та 4-феніл-5-R-1,2,4-тріазол-3-тіону / Куліш С. М., Панасенко О. І., Книш Є. Г.
[та ін.] // Матеріали 1-ї Міжнар. наук.-практ. конф. «Науково-технічний прогрес
і оптимізація технологічних процесів створення лікарських препаратів». –
Тернопіль, 2006. – С. 17–18.
10. Пошук фармакологічних активних речовин серед похідних 1,2,4-тріазол-3-тіону
/ Куліш С. М., Каплаушенко А. Г., Панасенко Т. О. [та ін.] // Матеріали IV
Міжнар. наук. конф. студентів та молодих вчених «Молодь та перспективи сучасної
медичної науки». – Вінниця, 2007. – С 156.
11. Препаративная органическая химия / под ред. Н.С. Вульфсона; пер. с польск.
В. В. Шпанова, В. С. Володиной. – М. : Хим. лит., 1959. – 888 с.
12. Свердлова О. В. Электронные спектры в органической химии / О. В. Свердлова.
– 2-е изд., перераб. – Л. : Химия, 1985. – 128 с.
13. Свердлова О. В. Электронные спектры в органической химии / О. В. Свердлова.
– Л. : Химия, 1973. – 98 c.
14. Синтез біологічно активних речовин на основі 5-R-4-R1-1,2,4-тріазол-3-тіону
і 4-аміно-1,2,4-тріазолу / Куліш С. М., Панасенко Т. В., Каплаушенко А. Г. [та
ін.] // Збірка матеріалів міжнар. конф. «Сучасні проблеми біології, екології та
хімії». – Запоріжжя, 2007. – С. 558–559.
15. Синтез фізико-хімічні та біологічні властивості 5-R-1,2,4-тріазол-3-тіону,
4-феніл-5-R-1,2,4-тріазол-3-тіону, 3-моно-(3,5-дибром)-1,2,4-тріазолу та їх
похідних / Куліш С. М., Пругло Є. С., Щербина Р. О., Ліснича А. М. // Актуальні
питання фармац. та мед. науки та практики : зб. наук. ст. – Запоріжжя, 2006. –
Вип. XVІІ. – С. 220. Физические методы в химии гетероциклических соединений / под
ред. А. Р. Катрицкого. – М. ; Л., 1966. – 371 с.
16. Штерн Э. Электронная абсорбционная спектроскопия в органической химии /
Штерн Э., Тиммонс К. // Методика комплексного спостереження за станом здоров’я
кардіологічних хворих на підставі аналізу психоемоціонального стану. – М. :
Мир, 1974. – 296 с.