д.х.н. 1Вигдорович
В. И, д.х.н. 2Цыганкова
Л.Е, д.х.н. 3Шель Н.В.,
к.х.н. 2Урядников
А.А., к.х.н. 2Есина М.Н.
1ФГБНУ «Всероссийский научно-исследовательский институт
использования техники и нефтепродуктов в сельском хозяйстве»
2ФГБОУ «Тамбовский государственный университет имени Г.Р.
Державина»
3ФГБОУ «Тамбовский государственный технический университет»
Некоторые особенности
процессов сорбционной очистки водных растворов от катионов металлов в
присутствии негидролизующихся анионов
Цель
настоящей работы – оценка характера влияния некоторых процессов в объеме
раствора на интервал рН при сорбционной очистке сред от катионов металлов в
присутствии негидролизующихся анионов.
Отметим, что
рассматриваемые процессы носят общий характер независимо от природы
гидролизующихся катионов и используемых сорбентов. Они имеют фундаментальное
значение для понимания особенностей протекания сорбции ионов тяжелых металлов.
Явление
гидратообразования. При
достижении некоторой критической величины водородного показателя очищаемой
воды, называемой обычно рН гидратообразования
(далее рНгидр)
протекают следующие реакции с участием двух- и трех зарядных простых и
гидролизованных катионов с образованием соответствующих практически
нерастворимых или малорастворимых гидроксидов металлов:
Двухзарядные
катионы:
![]()
![]()
Трехзарядные
катионы:
![]()


Величина рНгидр может быть рассчитана из зависимости:
![]() (1)
(1)
где KW,
Пр(Ме(ОН)Z) и
CMez+ -
соответственно ионное произведение воды, произведение растворимости
образующегося гидроксида металла и суммарная равновесная концентрация ионов.
Величина KW
является функцией температуры и в расчетах принята равной 10-14.
Значения произведений растворимости, использованные в расчетах, заимствованы из
[1-3].
Соответствующие
зависимости pHгидр как функции CMez+ ряда тяжелых металлов,
рассчитанные по уравнению (1), приведены на рис. 1.
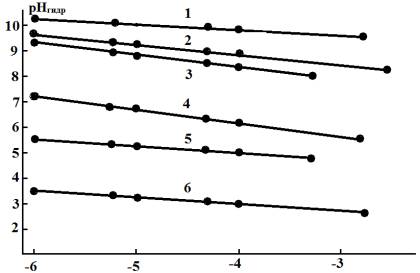
Рис.1. Влияние концентрации ряда катионов
тяжелых металлов на величину рН гидратообразования (Me(OH)Z).
1 – Cd(׀׀); 2 – Fe(׀׀); 3 –Pb(׀׀);
4 – Cu(׀׀); 5 – Bi(׀׀׀); 6 – Fe(׀׀׀).
Значение рНгидр является
функцией концентрации гидролизующихся ионов и увеличивается со снижением СМеz+.
Таким образом, по мере удаления из среды соответствующих катионов возрастают
величина рНгидр и
интервал рН, в котором возможна сорбционная очистка. Нижний предел рН этого
процесса определяется влиянием водородного показателя среды на природу
адсорбционных центров, верхний – величиной рНгидр. Однако этот интервал может быть расширен в
процессе сорбции.
В
процессе сорбционной очистки питьевых и сточных вод следует учитывать и еще
один фактор. Дело в том, что в отсутствие гидролизующихся анионов (анионы
сильных кислот – ClO4-, Cl-, NO3-, SO42-)
имеет место частичный гидролиз катионов тяжелых металлов по катиону. Этот
процесс протекает следующим образом:
двухзарядные катионы:
, (2)
трехзарядные
катионы:
, (3а)
и
далее за (3а) по второй ступени:
, (3б)
т.е.
суммарно:
![]() , (4)
, (4)
и
может приводить к заметному подкислению исходных растворов сточных вод.
Степень гидролиза h,
т. е. отношение концентрации (точнее активности) гидролизованных катионов к их
исходной концентрации можно рассчитать
по формуле:
![]() , (5).
, (5).
где - константа гидролиза. является, вообще говоря, важной
характеристической величиной катионов, но в справочниках она не приводится, так
как задается, в свою очередь, выражением:
 , (6).
, (6).
где
![]() - константа диссоциации основания с
отщеплением ионов гидроксила (i – номер стyпени
гидролиза). Для реакции (2, первая стадия) следует использовать
- константа диссоциации основания с
отщеплением ионов гидроксила (i – номер стyпени
гидролиза). Для реакции (2, первая стадия) следует использовать ![]() , для реакции (3б, вторая стадия) -
, для реакции (3б, вторая стадия) - ![]() . Значения
. Значения ![]() и
и ![]() могут достаточно
сильно различаться. Тогда с учетом уравнения (5) и (6) можно записать:
могут достаточно
сильно различаться. Тогда с учетом уравнения (5) и (6) можно записать:
![]() , (7).
, (7).
Возникает
вопрос – следует ли учитывать в расчетах в случае катионов Ме3+
вторую стадию гидролиза или можно ограничиться реакцией (3а)? Дело в том, что,
с одной стороны, нарастание концентрации ионов водорода по реакции (3а) смещает
равновесие стадии (3б) в сторону негидролизованной формы, т.е. подавляет гидролиз.
Но, с другой - ![]() заметно больше
заметно больше ![]() , что, напротив, его усиливает, повышая тем самым вклад
второй стадии гидролиза Ме(׀׀׀). Иначе говоря, существуют два
противоположно действующих фактора и учесть вклад каждого из них в настоящее
время не представляется возможным. Поэтому расчет рН растворов проводился с
учетом данных [1-3] по уравнению [4]:
, что, напротив, его усиливает, повышая тем самым вклад
второй стадии гидролиза Ме(׀׀׀). Иначе говоря, существуют два
противоположно действующих фактора и учесть вклад каждого из них в настоящее
время не представляется возможным. Поэтому расчет рН растворов проводился с
учетом данных [1-3] по уравнению [4]:
![]() ,
(8)
,
(8)
Полученные
результаты обобщены на рис. 2.
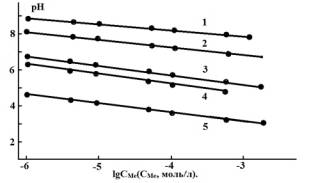
Рис. 2. Влияние гидролиза катионов ряда металлов
по первой ступени на величину рН растворов солей с негидролизующимся анионом. 1
– Cd(׀׀);
2 – Fe(׀׀); 3 – Cu(׀׀); 4 – Pb(׀׀); 5 – Fe(׀׀׀) и Bi(׀׀׀).
Повышение водородного показателя растворов в
результате снижения СМе вследствие их сорбции способствует
достижению ![]() и уменьшает
возможный интервал рН проведения сорбционного процесса.
и уменьшает
возможный интервал рН проведения сорбционного процесса.
Реальная
ситуация в растворах несколько сложнее, если в слабоминерализованной водной
среде присутствует растворенный CO2. Его взаимодействие с
водой по реакции:
CO2 + H2O
↔ H2CO3
приводит к образованию
угольной кислоты. При этих условиях, когда минерализация воды невелика,
концентрация CO2 в растворе близка к 0,35 мг/л, что
соответствует 8•10-6 моль/л угольной кислоты.
Пусть
электролитическая диссоциация H2CO3 подчиняется закону
разведения Оствальда:
и
![]() ,
,
откуда при ![]() = 4,45•10-7
[3] и α ≈ 1 величина рН раствора, равная
= 4,45•10-7
[3] и α ≈ 1 величина рН раствора, равная
рН = - lg(αCравн.), приближается к 5,1.
Часто в экологии его величину принимают близкой к 5,6, что коррелирует с экспериментальными
данными. Этому соответствует α ~ 0,31. В любом случае независимо от
точности расчетов в присутствии растворенного CO2 наблюдается
существенное подкисление среды, что сдвигает равновесие (3) в сторону
негидролизованной формы и заметно ослабляет роль гидролиза катионов тяжелых
металлов.
Литература
1. Рабинович В.А., Захавин
Э.Я. Краткий справочник химика. Л.: Химия. 1977. 376 с.
2. Лурье Ю.Ю. Справочник по
аналитической химии. М.: Химия. 1971. 454 с.
3. Справочник химика [под
ред. Б.П. Никольского]. М.: - Л.: Химия. 1964. Т. 3. 1006 с.
4. Алексеев В.Н.
Количественный анализ М.: Химия 1972. 504 с.