Химия / 5
студ. Фомина М.А., асп. Штейнгауэр А.Б.,
к.т.н., доц. Фомин А.А., д.т.н., проф. Родионов И.В., к.вет.н., доц. Красников
А.В. *, к.т.н., доц. Пошивалова Е.Ю.
Саратовский
государственный технический университет
имени Гагарина Ю.А.,
Россия
* Саратовский
государственный аграрный университет
имени Н.И. Вавилова,
Россия
Научные исследования проведены при финансовой
поддержке грантов
РФФИ № 13-03-00898 «а» и СП-1051.2012.4, а также проекта
№ 1189 в рамках базовой части государственного задания образовательным
организациям высшего образования, подведомственным Минобрнауки РФ, в сфере
научной деятельности.
Фазово-структурное состояние, физико-механические и химические свойства
оксидных покрытий матричного типа, полученных на титановом сплаве ВТ16 методом
индукционно-термической обработки
Введение
Конструктивной основой различных
внутрикостных имплантатов чаще всего служат биосовметимые металлические
материалы, например, титан и титановые конструкционные сплавы (ВТ6, ВТ16).
Современные высокоэффективные чрескостные имплантаты кратковременного
функционирования (остеофиксаторы) и стоматологические внутрикостные имплантаты
представляют собой металлическую малогабаритную конструкцию (ММК) с
биофункциональным покрытием [1].
Имплантат при установке находится под
действием интенсивной осевой нагрузки и в ряде случаев – тангенциальной,
возникающей при закручивании. Поверхность имплантата при этом подвергается
интенсивному трению и неизбежному износу [2, 3]. Эти явления вызваны
наличием твердых фрагментов в структуре кортикальной костной ткани. В ряде
случаев эта величина превышает твердость многих традиционно используемых
пористых покрытий, например, плазмонапыленных покрытий гидроксиапатита. Широкое
распространение получили различные методы оксидирования металлов, основными из
которых являются газотермическое, микродуговое и другие [4, 5]. Целью данной
работы является изучение влияния режимов перспективного метода
индукционно-термической обработки (ИТО) конструкционного титанового сплава ВТ16
на химический состав, фазово-структурное состояние, физико-механические
свойства и биосовместимые качества получаемых оксидных покрытий на поверхности
имплантационных ММК.
Методика
эксперимента
Экспериментальные
образцы ММК представляют собой цилиндры из конструкционного сплава ВТ16. Их
поверхность подвергается пескоструйной обработке корундовым абразивом.
Полученные ММК образцов также подвергаются ультразвуковой очистке в водных
растворах моющих поверхностно-активных веществ и спирте. Далее поверхность
подготовленных образцов оксидируется методом ИТО на воздухе
[2, 3, 6–10]. В ходе исследований устанавливалось влияние ИТО в
диапазоне температуры 600…1200 °C на
фазово-структурные и химические изменения, происходящие на поверхности при
образовании покрытий. Режимам обработки экспериментальных образцов покрытий
присвоена двойная нумерация: первое число соответствует температуре ИТО
металлической основы (06 – 600 °C, …, 12
– 1200 °C), второе – продолжительности
процесса термообработки, отсчитываемой в секундах.
Фазово-структурное
состояние поверхности образцов после ИТО изучалось с применением
рентгенофазового анализа (РФА). Морфология покрытий исследовалась для выявления
закономерностей структурообразования. Для этого использовалась растровая
электронная микроскопия (РЭМ) в сочетании с энергодисперсионным
рентгенфлуоресцентным анализом (ЭДРФА) химического состава покрытий и
приповерхностного слоя образцов.
Физико-механические
свойства покрытий оценивались методами наноиндентирования при использовании
тестера механических свойств NANOVEA.
Основными определяемыми величинами являлись твердость и модуль упругости.
Проверка
биосовместимости изучаемых образцов покрытий проводилась в условиях in vivo. Образцы имплантатов с опытными типами оксидных
покрытий с наилучшим сочетанием морфологических характеристик и
физико-механических свойств покрытий имплантировались в костные фрагменты
опытных животных. При этом оценивалась способность к остеоинтеграции, т.е.
способности к образованию костной ткани вокруг имплантата.
Результаты
исследования и их анализ
На
поверхности титанового сплава ВТ16 при ИТО формируются оксидные покрытия [2, 6,
9]. Фазовый состав поверхности представлен диоксидом титана TiO2,
находящимся в виде рутила, и титаном различного типа кристаллической
структуры (рис. 1).
Структура оксидных
покрытий обусловлена процессами интенсивного окисления металлической основы ММК
при теплофизическом воздействии токов высокой частоты (рис. 2, а; 2, б).
Форма кристаллов рутила зависит преимущественно от температуры ИТО, так при
600 °C образуются округлые зерна,
равномерно покрывающие микрорельеф основы. С увеличением температуры до
800 °C и продолжительности ИТО свыше
120 сек размер кристаллов увеличивается и составляет
90 ± 15 нм (рис. 2, в). При температуре ИТО, равной 1000 °C, величина кристаллов покрытия достигает
200…250 нм (рис. 2, г).
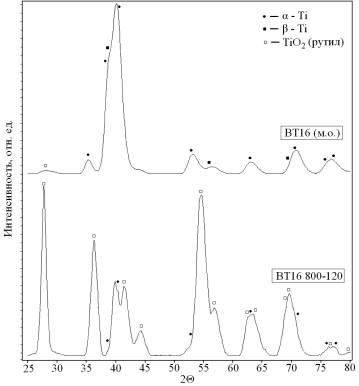
Рис. 1. Дифрактограммы образцов ММК из сплава
ВТ16 до (верхний спектр) и после (нижний спектр) оксидирования методом ИТО
Изменения химического состав, происходящие
на поверхности сплава ВТ16, наглядно показаны при использовании РЭМ в сочетании
с ЭДРФА (рис. 3). Образованное покрытие рутила содержит в своем составе,
помимо основных компонентов титана и кислорода, примеси алюминия и ванадия
(табл. 1).

Рис. 2.
Морфология поверхности титанового сплава ВТ16 в микро- и нанометровом масштабе:
а, в – после травления и ИТО 800-120; б, г – после травления и
ИТО 1000-120

Рис. 3.
Микроструктура ВТ16 с оксидным покрытием матричного типа (режим ИТО 1000-120): I – смола ЭДП-20; II – покрытие;
III – термически упрочненная область; IV – основа ММК
Таблица 1
Результаты ЭДРФА образца оксидного покрытия,
полученного при режиме ИТО 1000-120 (см. рис. 3)
|
Спектр |
Химический состав, ат. % |
||||
|
O |
Ti |
Al |
V |
Mo |
|
|
1 |
63.67 |
34.66 |
0.58 |
1.09 |
- |
|
2 |
69.71 |
28.75 |
0.56 |
0.99 |
- |
|
3 |
57.47 |
37.71 |
3.67 |
1.15 |
- |
|
4 |
25.80 |
63.22 |
4.34 |
4.15 |
2.49 |
|
5 |
- |
79.63 |
7.29 |
8.14 |
4.94 |
|
6 |
26.71 |
62.12 |
3.83 |
4.62 |
2.72 |
|
7 |
- |
89.00 |
5.28 |
3.72 |
2.00 |
|
8 |
- |
87.64 |
4.90 |
4.95 |
2.51 |
|
9 |
- |
88.64 |
4.40 |
4.89 |
2.06 |
|
10 |
- |
88.40 |
4.59 |
4.62 |
2.38 |
|
11 |
- |
89.11 |
4.46 |
4.71 |
1.71 |
|
12 |
- |
88.04 |
5.47 |
4.51 |
1.98 |
|
13 |
- |
89.69 |
4.57 |
3.78 |
1.96 |
|
14 |
- |
88.68 |
4.77 |
4.58 |
1.96 |
|
15 |
- |
88.94 |
4.47 |
4.68 |
1.91 |
|
16 |
72.26 |
26.16 |
0.85 |
0.73 |
- |
|
17 |
- |
86.39 |
5.51 |
5.28 |
2.83 |
|
18 |
- |
86.74 |
6.03 |
4.84 |
2.39 |
|
19 |
- |
87.91 |
5.36 |
4.84 |
1.89 |
|
20 |
- |
88.65 |
4.72 |
4.53 |
2.10 |
|
21 |
- |
88.73 |
4.85 |
4.22 |
2.19 |
Поверхностный
слой образцов ММК характеризуются определенными значениями твердости и модулем
упругости (табл. 2). ИТО способствует повышению твердости поверхностного
слоя сплава ВТ16 на 25…45 %. Это объясняется образованием слоя рутила,
толщина которого составляет не менее 3 мкм, и термически упрочненного слоя с
повышенной твердостью толщиной 5…7 мкм (рис. 3).
Таблица 2
Физико-механические
свойства сплава ВТ16 и оксидных покрытий
|
Образец |
Твердость,
ГПа |
Модуль |
|
ВТ16 |
2,86…4,06 |
238…294 |
|
ВТ16 800-120 |
4,17…5,60 |
109…153 |
|
ВТ16
1200-120 (подслой) |
3,60…4,00 |
86…95 |
|
ВТ16 1000-030
(подслой) |
4,96…5,47 |
194…195 |
Проверка биосовместимости in vivo образцов ММК с покрытиями TiO2
произведена с использованием опытных животных (кроликов породы «Серый великан») (рис. 4, б). ММК с оптимальным соотношением
состава, структуры и физико-механических свойств (режим ИТО 800-120)
использованы при лечении собак (рис. 4, а). Установлено, что высокая морфологическая гетерогенность
поверхностной структуры позволяет обеспечить надежную остеоинтеграцию (рис. 5, а).
Поверхность образцов имплантатов с оксидными покрытиями характеризуется
наличием крупных фрагментов костной ткани (рис. 5, б).
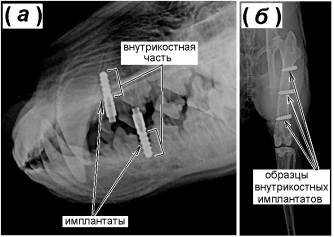
Рис. 4. Рентгенограммы результатов лечения (собак) с
использованием имплантатов (а) и
тестирования in vivo (на
кроликах) образцов (б) с оксидными
покрытиями

Рис. 5. Макро-
(а, б) и микрометровый (в, г) уровни морфологии поверхности
имплантата из сплава ВТ16 с покрытием после испытаний in vivo
Тип биоинтеграционного взаимодействия, т.е.
наличие остеоинтеграции или фиброостеоинтеграции, можно выявить при
использовании ЭДРФА (рис. 6). Результаты химического анализа фрагментов
биологической ткани на поверхности свидетельствуют о наличии кальция и фосфора,
т.е. наличия гидроксиапатита (табл. 3).

Рис. 6. Анализ химического состава границы «имплантат –
кость»:
а – макроструктура; б
– микроструктура
Таблица 3
Результаты ЭДРФА образца ММК, полученного при режиме
ИТО 800-120, после испытаний in vivo в
течение 60 сут. (см. рис. 6)
|
Спектр |
C |
O |
Al |
P |
Ca |
Ti |
Ca/P |
|
1 |
34.42 |
42.80 |
2.48 |
1.47 |
2.37 |
16.46 |
1.61 |
|
2 |
27.26 |
50.05 |
2.06 |
2.24 |
3.65 |
14.74 |
1.63 |
|
3 |
58.76 |
31.40 |
|
3.70 |
6.14 |
|
1.66 |
|
4 |
62.91 |
31.49 |
|
2.51 |
3.09 |
|
1.23 |
|
5 |
87.34 |
|
|
|
12.66 |
|
|
|
6 |
67.30 |
19.61 |
|
5.24 |
7.85 |
|
1.50 |
|
7 |
22.98 |
46.31 |
2.21 |
|
|
28.50 |
|
|
8 |
37.49 |
35.65 |
1.63 |
3.65 |
6.41 |
15.17 |
1.76 |
|
9 |
65.81 |
33.19 |
0.30 |
0.25 |
0.28 |
0.16 |
1.12 |
|
10 |
62.53 |
28.69 |
|
3.25 |
5.53 |
|
1.70 |
|
11 |
40.26 |
41.56 |
1.09 |
1.72 |
3.05 |
12.31 |
1.77 |
|
12 |
86.52 |
12.91 |
|
0.27 |
0.30 |
|
1.11 |
|
13 |
69.64 |
18.14 |
|
5.20 |
7.03 |
|
1.35 |
|
14 |
55.48 |
33.39 |
0.68 |
0.58 |
1.46 |
8.41 |
2.52 |
|
15 |
40.37 |
44.94 |
1.72 |
0.95 |
2.44 |
9.58 |
2.57 |
|
16 |
73.31 |
24.92 |
0.18 |
0.65 |
0.78 |
0.16 |
1.20 |
|
17 |
68.11 |
27.92 |
|
1.69 |
2.28 |
|
1.35 |
Выводы
Структура
поверхности титанового сплава ВТ16 после ИТО характеризуется образованием
покрытия диоксида титана (рутила) с высокими показателями морфологической
гетерогенности микроструктуры, твердости и биосовместимыми качествами. Покрытия
диоксида титана образованы нанометровыми и субмикрометровыми кристаллами
овальной и призматической формы. Наилучшие показатели морфологии в сочетании с
высокой твердостью и повышенными качествами биосовместимости достигаются при
режимах ИТО 800-030, 1000-001, 1000-030 (подслой), 1200-001 (подслой), 1200-030
(подслой), а также в наибольшей степени 800-120 и 1000-120 (подслой).
Литература
1. Paital S.R., Dahotre N.B. Calcium phosphate coatings for bio-implant
applications: Materials, performance factors, and methodologies // Materials
science and engineering R. 2009. № 66. pp.
1–70.
2. Фомин А.А., Штейнгауэр А.Б., Родионов И.В. и др.
Свойства покрытий диоксида титана, полученных индукционно-термическим оксидированием
сплава ВТ1-00 // Трение и износ. 2014. Т. 35. № 1. С. 43–51.
3. Штейнгауэр А.Б., Фомин А.А., Родионов И.В. и др.
Повышение биосовместимости покрытий диоксида титана, полученных индукционно-термическим
оксидированием медицинского титана // Медицинская физика. 2013. № 4 (60). С. 83–88.
4. Rodionov I.V. Application
of the Air-Thermal Oxidation Technology for Producing Biocompatible oxide
coatings on periosteal osteofixation devices from stainless steel // Inorganic materials: Applied research. 2013. № 2 (4). pp. 119–126.
5. Кошуро В.А., Нечаев Г.Г.,
Лясникова А.В. Влияние плазменных процессов формирования покрытий на
механические характеристики изделий из титановых сплавов // Упрочняющие
технологии и покрытия. 2013. № 10 (106). С. 18–22.
6. Фомин А.А., Штейнгауэр А.Б., Родионов
И.В. и др. Наноструктура покрытий из диоксида титана, модифицированного
гидроксиапатитом, на медицинских титановых имплантатах // Медицинская техника. 2013. № 3. С. 24–27.
7. Фомин
А.А., Штейнгауэр А.Б., Родионов И.В. и др. Оборудование для индукционно-термической
обработки малогабаритных металлических изделий // Индукционный нагрев. 2013. №
2 (24). С. 44–47.
8. Фомин А.А., Штейнгауэр А.Б., Родионов И.В. и др. Нанокристаллическая структура поверхностного
слоя технически чистого титана, подвергнутого
индукционно-термическому оксидированию // Письма в Журнал технической физики. 2013.
Т. 39. Вып. 21. С. 70–75.
9. Fomin A.A.,
Rodionov I.V., Steinhauer A.B. et al. Structure of Composite Biocompatible
Titania Coatings Modified with Hydroxyapatite Nanoparticles // Advanced Materials Research, 2013.
Vol. 787. pp. 376–381.
10. Fomin A.A., Rodionov I.V.,
Steinhauer A.B. et al. Nanostructure of biocompatible titania/hydroxyapatite
coatings // Proceedings of SPIE. 2014. Vol.
9031. pp. 90310H.