Аспирант Альберт Е.В., д.б.н.
профессор Ежова Т.А.
Московский государственный университет
им. М.В. Ломоносова, Россия
Влияние
генетического фона на экспрессивность мутации na Arabidopsis
thaliana
Карликовая мутация nana (na) из коллекции кафедры
генетики МГУ была получена с помощью индуцированного мутагенеза из расы Enkheim
(Янушкевич, 1985). При возвратном скрещивании мутанта с растениями этой расы
наблюдали моногенное полудоминантное наследование карликовости (табл.1). Причем
гомозиготные карликовые мутанты либо вообще не были способны образовывать
цветонос и погибали на стадии розетки, либо давали цветонос, который формировал
единичные цветки (1-3 цветка на главном цветоносе). Гетерозиготные мутанты
характеризовались более высокой плодовитостью. Они образовывали на главном
цветоносе 5-15 цветков, после чего апикальная меристема прекращала
пролиферацию. Длина главного цветоноса гетерозигот по мутации na составляла 0,8 – 2,0 см.
Помимо главного цветоноса, который не только имел меньшее число узлов, но и укороченные
междоузлия, гетерозиготы образовывали многочисленные розеточные побеги, которые
могли превышать длину главного цветоноса и достигать 3-5 см длины.
Аналогичный уровень
экспрессивности мутации na
наблюдался
на фоне расы Dijon-M, а также линии Ler. В то же время, при
скрещивании с растениями расы Columbia
фенотип наблюдалось существенное падение экспрессивности na в гетерозиготном состоянии. Высота главного
цветоноса гибридов F1
достигала 27 см (19 – 27 см). Такие гибриды отличались от растений дикого типа
лишь сокращенной (в 2-3 раза) длиной вегетативных узлов цветоноса. В поколении F2
наблюдали выщепление стерильных мутантных гомозигот (фенотип как и на фоне Enkheim),
растений не отличающихся по морфологии от дикого типа, а также самых
разнообразных полукарликовых растений. Среди полукарликов были как похожие на
гибриды F1, так и растения с фенотипом гетерозигот на фоне расы Enkheim.
Расщепление в F2 отличалось от моногенного - наблюдалось увеличение доли
растений дикого типа и снижение доли гетерозигот (табл. 1)
Таблица
1. Расщепление в F2 от скрещивания мутанта na с растениями рас Enkheim
(En) и
Columbia (Col)
|
Вариант
скрещиваний |
Число
мутантных растений |
Число
растений дикого типа (доля) |
Всего
растений |
Х2(1:2:1)
, (р=0,05) |
|
|
гомозигот
(доля) |
гетерозигот
(доля) |
||||
|
F2 na
× En |
64(0,25) |
135(0,52) |
59(0,23) |
258 |
0,763 |
|
F2 na
× Сol |
85 (0,19) |
164
(0,37) |
188 (0,43) |
437 |
75,11 |
Наблюдаемые различия в
экспрессивности мутации na
на разном
генетическом фоне могут быть связаны с разными причинами. Во-первых, они могут
объясняться возможной дигенной природой мутации. Можно было бы предположить,
что в исходной расе Enkheim (но не в расе Columbia)
имеется аллель гена – модификатора в гомозиготном состоянии, усиливающая
проявление мутации na.
Поэтому на фоне родительской расы Enkheim наблюдается моногенное
расщепление по признаку карликовости (1 часть растений дикого типа: 2 части
гетерозиготных карликовых мутантов: 1 часть гомозиотных карликов), а на фоне
расы Columbia расщепление – иное (табл. 1). Однако в этом случае
в F3 от скрещивания растений na с растениями расы Columbia должны были бы выщепляться
семьи с различным типом расщеплений (моногенным или дигенным) и с разным проявлением
na в гетерозиготе –
характерном как для Columbia, так и для Enkheim.
Проведенный нами анализ F3 подобной
неоднородности не выявил, что позволяет отклонить гипотезу дигенного наследования карликовости.
Во-вторых, можно
предположить, что изменение фенотипа гетерозигот на фоне Columbia является
результатом межаллельного взаимодействия, похожего на явление парамутации, которое
обусловлено изменением эпигенетического состояния одной аллели под влиянием другой
(1). Поскольку доминантные мутации, как правило, являются результатом
эктопической экспрессии мутантной аллели, можно предположить, что аллель NA дикого типа,
присутствующая у расы Columbia, вызывает изменение
метилирования мутантной аллели na,
что приводит к её замолканию и частичному восстановлению карликовости у
гетерозиготных растений. В пользу эпигенетического изменения мутантной аллели na под влиянием аллели NA расы Columbia свидетельствуют данные
анализа фенотипа растений F3 (рис. 1). Установлено,
что проявление карликовости у растений F3 от скрещивания мутанта
с расой Columbia зависело от фенотипа материнского растения, с
которого собирались семена. Среди потомков F3 от растений F2,
имеющих длину главного цветоноса 1,2-1,5см, преобладали растения с длиной
главного цветоноса ≤ 1 см (59%), а растения выше, чем 15 см составляли
29% (рис. 1а). Среди потомков растений F2,
имеющих высоту 3-5-см, доля растений ≤ 1 см составила всего 23%, что
соответствует примерной ожидаемой частоте мутантных гомозигот. В то же время,
наблюдалось существенное повышение доли растений выше 1 см, но меньше 5 см
(30%), а также растений ≥ 5 см, но ниже 15 см (17%, рис. 1б). Среди
потомков 7-8 см растений F2 преобладали растения ≥ 5 см, но ниже 15 см (34%) и растений ≥ 15 см (35%, рис. 1в). И, наконец, в
потомстве самых высоких (20-22 см) гетерозигот F2 доля растений ≥ 15 см составляла уже 52%, рис. 1г). Т.е. чем выше были гетерозиготы F2,
тем больше высоких гетерозигот наблюдали в следующем поколении, и – наоборот. Эти
данные являются убедительным свидетельством появления наследуемых модификаций,
т.е. эпигенетических изменений мутации na на фоне расы Columbia.
Большинство парамутаций описано на кукурузе, причем во всех случаях локусы, вовлеченные в это явление характеризовались наличием повторов ДНК (2-7). У Arabidopsis thaliana описан ряд локусов, которые подвержены эпигенетическим модификациям (8,9,10), однако типичных парамутаций пока не выявлено. Лишь для локуса PAI у гибридов F1 от скрещивания растений расы Ws с растениями расы Columbua обнаружено замолкание одного из генов этого локуса (PAI1) в результате взаимодействия с аллельными геном (11), однако о наследовании половыми потомками этого эпигенетического изменения не сообщается.
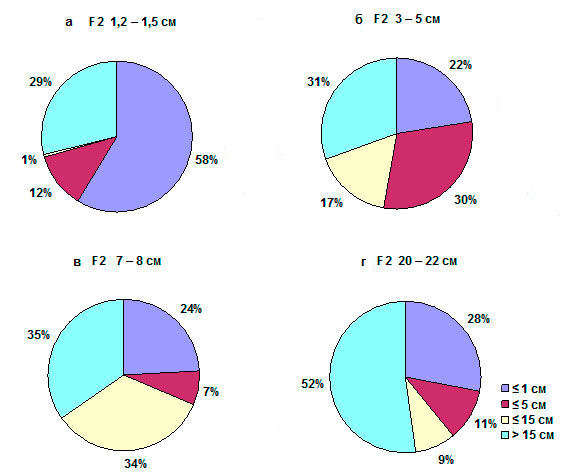
Рисунок 1. Распределение
по высоте главного цветоноса потомков гетерозиготных растений F2 (na Х Columbia),
различающихся по высоте цветоноса. Высота цветоноса родительских растений F2
поколения 1,2-1,5 см (а), 3-5 см (б), 7-8 см (в) и 20-22 см (г). Разными
цветами показаны 4 класса потомков F3 с разной длиной
цветоноса.
Эпигенетические
изменения мутантного аллеля гена na
под влиянием
аллеля этого гена из расы Columbia передаются потомкам.
Таким образом, мутация na является
случаем, наиболее близким к классическим парамутациям, обнаруженным в основном у кукурузы. Тем не менее, причины
неизменности фенотипа гомозиготных растений na вне зависимости от
генетического фона остаются неясными.
Работа поддержана
Российским фондом фундаментальных исследований (Проект
РФФИ № 13-04-00122-а)
и Российской государственной программой по поддержке научных школ (проект №
376.2012.4).
Литература:
1. Brink R.A., Styles E.D., Axtell J.D. Paramutation:
directed genetic change. Science 1968, 159:161–170.
2. Kermicle J.L., Eggleston W.B., Alleman M.
Organization of paramutagenicity in R-stippled
in maize. Genetics 1995, 141:361–372.
3. Eggleston WB, Alleman M, Kermicle JL: Molecular
organization and germinal instability of R-stippled
in maize. Genetics 1995, 141:347–360.
4. Walker E.L., Robbins T.P., Bureau T.E., Kermicle J.L.,
Dellaporta S.L. Transposon-mediated chromosomal rearrangements and gene duplications
in the formation of the maize R-r complex. EMBO J. 1995, 14:2350–2363.
5. Patterson G.I., Kubo K.M., Shroyer T., Chandler V.L.
Sequences required for paramutation of the maize b gene map to a region containing the promoter and upstream
sequences. Genetics 1995, 140:1389–1406.
6. Hollick J B, Patterson G I, Coe E H Jr., Cone K C,
Chandler V L: Allelic interactions heritably alter the activity of a metastable
maize pl allele. Genetics 1995,
141:709–719.
7. Ronchi A., Petroni K., Tonelli C. The reduced
expression of endogenous duplications (REED) in the maize R gene family is mediated by DNA methylation. EMBO J. 1995,
14:5318–5328.
8. Jacobsen S.E., Sakai H.,
Finnegan E.J., Cao X., Meyerowitz E.M. Ectopic hypermethylation of
flower-specific genes in Arabidopsis. Curr Biol. 2000, 10:179–186.
9. Jacobsen S E, Meyerowitz E M. Hypermethylated SUPERMAN epigenetic
alleles in Arabidopsis. Science. 1997, 277:1100–1103.
10. Stokes T.L., Kunkel B.N., Richards E.J.
Epigenetic variation in Arabidopsis disease resistance. Genes Dev. 2002, 16(2): 171–182.
11. Bender J.,
Fink G.R. Epigenetic control of an endogenous gene family is revealed by a
novel blue fluorescent mutant of Arabidopsis.
Cell 1995, 83:725–734.