Панасенко В.В.,
Гринь Г.И., Лавренко А.А., Федорченко Т.В., Бондаренко Л.Н., Малик
О.И.
Национальный технический
университет
«Харьковский политехнический институт», Украина
Исследования процесса
отгонки диэтиламина в системе
CaCl2 – (С2Н5)2NH – H2O
Процесс отгонки (C2H5)2NH
является неотъемлемой частью технологии карбоната калия. Однако данные о фазовых равновесиях для системы
CaCl2(р) – (С2Н5)2NH(р)
– H2O в литературе ограничены, а для небольших давлений отсутствуют
вообще. Хотя подобные сведения представляют не только теоретический интерес,
так как такая система – объект для исследования закономерностей процесса
отгонки, она имеет еще и практическую значимость, необходимую для определения
рациональных параметров дистилляции, разработки технологической схемы процесса
регенерации (C2H5)2NH и во многом
предопределяют безвозвратные потери дорогостоящего реагента и расход водяного
пара. Из литературы известны предложения по осуществлению регенерации аминов из
их хлоридов, используя для этой цели гидроксид кальция как один из самых
недорогих и эффективных реагентов [1 – 6]. Для этого необходимо знать
направленность реакции
Ca(OH)2(р)
+ 2(C2H5)2NH2Cl(р) = CaCl2(р)
+ 2(C2H5)2NH(р)
+ 2H2O(ж)
и
возможность наиболее полной отгонки (C2H5)2NH
для возврата его в технологический цикл аналогично тому, как это происходит в
замкнутом цикле использования аммиака в
производстве кальцинированной соды. Согласно термодинамическим
данным [7] реакция обратима и протекает с заметной
скоростью уже при стандартной температуре 298,15 K и давлении 101,32 кПа. По данным исследований авторов [8 – 10] важную роль в процессе отгонки играет давление. Так, при
уменьшении давления от 101,32 до 48,64 кПа увеличение содержания хлорида
кальция в жидкой фазе приводит к увеличению содержания (C2H5)2NH
в паре при одних и тех же температурах. Поэтому представляет интерес изучение
процесса отгонки (C2H5)2NH из водных растворов
хлорида кальция при давлениях 47,996, 21,331 и 7,999 кПа, что и стало целью и
заданием настоящих исследований.
Процесс отгонки (C2H5)2NH
из исходного водного раствора, содержащего массовую долю CaCl2 –
20 % и (C2H5)2NH
– 5 % осуществляли методом однократного испарения [9, 11]. В отобранной пробе
определяли содержание (C2H5)2NH методом
отгонки по Кьельдалю, содержание иона кальция устанавливали трилонометрическим
методом, содержание иона хлора определяли аргентометрически с использованием
блока автоматического титрования БАТ-15.
Обработку экспериментальных данных проводили методами математической
статистики, регрессионного анализа [12, 13] с помощью пакета прикладных
программ.
В качестве исходных данных для анализа брали
показатели экспериментальных замеров: время от начала опыта, мин; давление над
раствором, кПа; температура раствора, ºС; содержание CaCl2 и соответственно – (C2H5)2NH,
%.
Как видно из таблицы и рисунка при увеличении
содержания хлорида кальция в растворе более 27 – 28 % температура раствора
медленно начинает возрастать. Из зависимостей для всех трех различных значений
давления надо полагать, что температура раствора не возрастает до тех пор, пока
содержание хлорида кальция не увеличится больше определенного значения, что
указывает на физический процесс отгонки до данной концентрации. Следует
отметить, что для всех случаев молекулярное соотношение между водой и безводным
хлоридом кальция, при котором начинает обнаруживаться рост температуры,
составляет 15:1. Как вывод, можно предположить, что при молекулярном
соотношении H2O и (C2H5)2NH около
(12 – 15):1, вода находится в связанном состоянии, образуя что-то вроде жидкого
кристаллогидрата CaCl2·12H2O, разрушение которого требует больших
затрат энергии а, следовательно, и температур. Более же низкая температура
соответствует более высокой концентрации (C2H5)2NH.
Таблица
Результаты
кинетических исследований отгонки диэтиламина в системе
CaCl2 – (С2Н5)2NH – H2O
|
Время, мин |
Давление над раствором, кПа |
||||||||
|
47,996 |
21,331 |
7,999 |
|||||||
|
Температура раствора, оС |
Массовая доля компонента, % |
Температура раствора, оС |
Массовая доля компонента, % |
Температура раствора, оС |
Массовая доля компонента, % |
||||
|
(C2H5)2NH |
СаСl2 |
(C2H5)2NH |
СаСl2 |
(C2H5)2NH |
СаСl2 |
||||
|
5 |
83,0 |
0,750 |
20,96 |
64,0 |
1,290 |
20,83 |
44,0 |
0,889 |
20,88 |
|
10 |
86,0 |
0,145 |
21,37 |
67,0 |
0,515 |
21,38 |
48,0 |
0,708 |
21,72 |
|
15 |
86,5 |
0,107 |
23,45 |
67,5 |
0,126 |
22,90 |
50,0 |
0,202 |
23,90 |
|
20 |
87,5 |
0,087 |
23,80 |
70,0 |
0,074 |
24,60 |
50,5 |
0,190 |
27,06 |
|
30 |
88,0 |
0,077 |
25,73 |
71,0 |
0,069 |
26,25 |
52,0 |
0,093 |
29,29 |
|
40 |
89,0 |
0,041 |
28,08 |
72,0 |
0,059 |
30,55 |
56,0 |
0,087 |
30,40 |
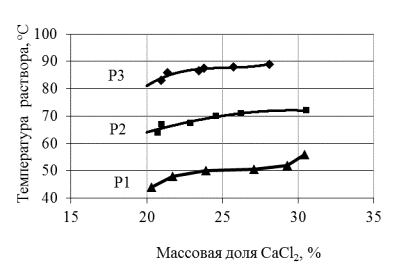
Рисунок –
Зависимости температуры раствора от содержания хлорида кальция
Обозначения: Р1 – 47,996 кПа; Р2 – 21,331 кПа; Р3 – 7,999 кПа.
Зависимость температуры раствора от содержания хлорида
кальция имеет нелинейный характер от давления и может быть описана с точностью
до
1 – 2 °C для горизонтального
температурного участка в виде логарифмической функции tр =
20,59·ln(P) + 0,034, где:
tр –
температура раствора, °C;
Р – давление, кПа. Коэффициент
детерминации R² = 0,995.
Поскольку данная система является трехкомпонентной,
для ее описания достаточно знать закономерности изменения двух компонентов. При
этом масса хлорида кальция в системе не изменяется (остается в растворе).
Содержание хлорида кальция в растворе не может
рассматриваться в качестве кинетического показателя, поскольку он является
вторичным, хотя и должен приниматься во внимание как возможный влияющий
параметр.
Таким образом, кинетика процесса может быть
представлена кинетикой изменения количеств H2O и (C2H5)2NH.
В качестве основного показателя для (C2H5)2NH
может быть взято содержание (C2H5)2NH в
растворе (С(C2H5)2NH). В
качестве основного показателя для воды – количество испаренной воды.
Литература:
1. Wasag T. Otrzymywanie potazu metoda
aminowa z zastosowaniem dwuetyloaminy [Текст] /
T. Wasag, T. Wasag,
U. Slewleleo, G. Poleszczuk
// Przemysl chemiczny, 1974. – Vol.
53, N 2. – P. 94 – 97.
2. Ullmanis Encuklopedie der technischen
Chemie. – 1977. – 4.
Band 13. – 717 p.
3. Rant Z. Dіe Erzeugung
von Soda nach dem Solvau Verfahren [Текст] / Z. Rant. – Sarajevo: Forschungsіnstіtut für Bergbau und Chem. Technol. – Tuzla, 1968. – 543 s.
4. Яжембовская Я.
Возможности регенерации амина из фильтровой жидкости в содовом процессе [Текст] / Я. Яжембовская // Международный симпозиум социалистических стран по
содовой промышленности (Славянск / НИОХИМ, 1969). – Харьков, 1971. – С. 111 –
114.
5. Wasag T. Badania nad regeneracja dwuetyloaminy w aminowej methodize otrzymywania sodu. Rownowaga
ciecz – para ukladu: (С2Н5)2NH – CaCl2 –NaC1 – H2O [Текст] / T. Wasag, M. Kurzawa //
Prace naukowe Politechniki Szczecinskiej. № 86. Zastosowanie amin do produkcji
weglanow alkalicznych. – Szczecin, 1977. – S. 19 – 29.
6. Панасенко В.В. Растворимость в системе KНСО3 – (С2Н5)2NН2Cl – Н2О при 30 °С [Текст] / В.В. Панасенко, Г.И. Гринь, С.А. Мазунин, В.А. Панасенко // Журнал неорганической химии. – Москва, 2012. – Т. 57, № 2. – С. 330 – 333.
7. Панасенко
В.В. Термодинамика химических реакций в технологии карбоната калия [Текст] /
В.В. Панасенко, Г.И. Гринь, В.А. Лобойко, А.А. Лавренко, А.В. Кобзев //
Інтегровані технології та енергозбереження. – Харків, 2012. – № 1. – С. 28 –
36.
8. Панасенко В.А. Исследование
процесса десорбции диэтиламина [Текст] / В.А. Панасенко, С.А. Мазунин, Г.И. Гринь, А.А. Вайсброд, И.В. Бондаренко // Труды Международной
научной конференции «Информационные технологии: наука, техника, технология,
образование, здоровье», 12 – 14 мая 1997 г. – Харьков: ХГПУ, 1997. – С.86 – 89.
9. Панасенко В.А.
Равновесие жидкость – пар в системе вода – диэтиламин – хлорид кальция [Текст] / В.А. Панасенко, С.А. Мазунин, Г.И. Гринь // Вестник Харьковского
Государственного политехнического университета (ХГПУ). – Харьков: ХГПУ, 2000. –
Вып. 105 – С. 76 – 79.
10. Панасенко В.В. Закономерности процесса отгонки диэтиламина из водного
раствора хлорида кальция [Текст] / В.В.
Панасенко, Г.И. Гринь, С.А. Мазунин, П.В. Кузнецов // Вестник БГТУ им. В.Г. Шухова. – Белгород, 2013. – № 2. – С. 144 –
148.
11. Коган В.Б.
Равновесие между жидкостью и паром [Текст] / В.Б. Коган, В.М. Фридман,
В.В. Кафаров. – М. – Л.: Наука, 1966. – 1426 с.
12.
Румшинский Л.З. Математическая обработка результатов эксперимента [Текст] / Л.З. Румшинский. – М.: Наука,
1971. – 192 с.
13. Радченко С.Г. Устойчивые методы оценивания
статистических моделей : Монография. – Киев: ПП «Санспарель», 2005. – 504 с.